Nota Sains Bab 6 Tingkatan 5: ELEKTROKIMIA
RINGKASAN
Ringkasan (Nota Sains Bab 6 Tingkatan 5: ELEKTROKIMIA)
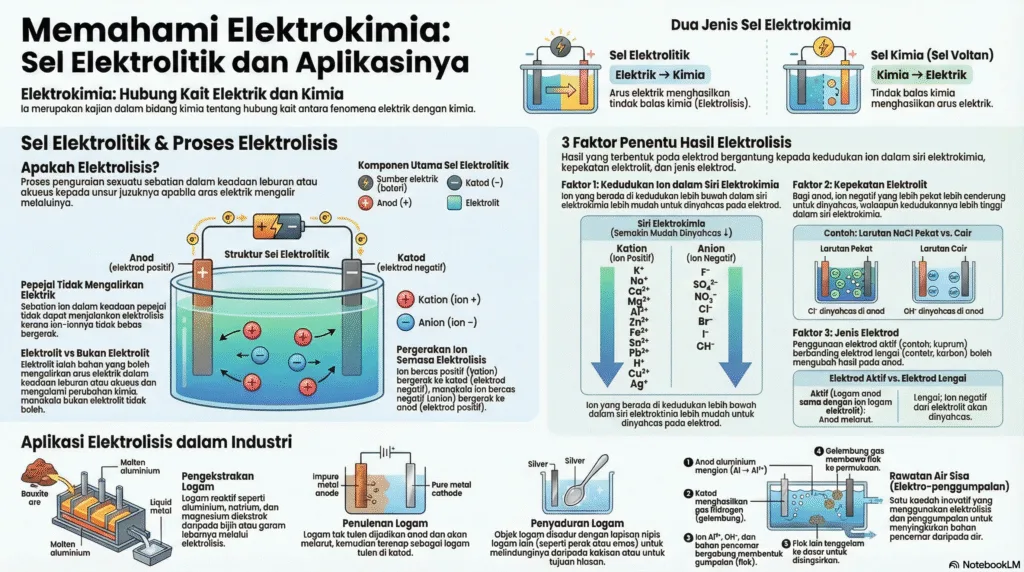
Elektrokimia ialah bidang kajian dalam kimia yang menerangkan hubung kait antara fenomena elektrik dan kimia. Terdapat dua jenis sel elektrokimia utama: sel elektrolitik dan sel kimia.
Sel Elektrolitik berfungsi melalui proses elektrolisis, iaitu penguraian sebatian dalam keadaan leburan atau akueus kepada unsur juzuknya apabila arus elektrik mengalir melaluinya. Dalam sel ini, tenaga elektrik ditukarkan kepada tenaga kimia. Sebuah sel elektrolitik terdiri daripada sumber elektrik (bateri), elektrod (anod dan katod), dan elektrolit. Anod ialah elektrod yang disambungkan ke terminal positif, manakala katod disambungkan ke terminal negatif. Elektrolit ialah bahan yang boleh mengalirkan arus elektrik (dalam bentuk leburan atau akueus) dan mengalami perubahan kimia, yang terdiri daripada ion positif (kation) dan ion negatif (anion). Hasil elektrolisis dipengaruhi oleh tiga faktor utama: kedudukan ion dalam siri elektrokimia, kepekatan elektrolit, dan jenis elektrod yang digunakan. Aplikasi elektrolisis dalam industri adalah luas, termasuk pengekstrakan logam, penulenan logam, penyaduran logam, dan pengolahan air sisa melalui elektro-penggumpalan.
Sel Kimia (juga dikenali sebagai sel voltan atau sel galvani) berfungsi sebaliknya. Dalam sel ini, perubahan kimia yang berlaku menghasilkan arus elektrik, menukarkan tenaga kimia kepada tenaga elektrik. Sel kimia ringkas terdiri daripada dua jenis logam berlainan yang dicelup dalam satu elektrolit. Logam yang lebih elektropositif (kedudukan lebih tinggi dalam siri elektrokimia) akan menjadi terminal negatif (anod), manakala logam yang kurang elektropositif akan menjadi terminal positif (katod). Aliran elektron dari terminal negatif ke terminal positif melalui litar luar menghasilkan tenaga elektrik. Konsep ini diaplikasikan dalam penghasilan tenaga daripada pelbagai sumber, seperti bateri kereta elektrik dan sel buatan sendiri menggunakan buah-buahan atau sayur-sayuran.
GLOSARI
| Istilah | Definisi |
| Anion | Ion yang bercas negatif yang bergerak ke anod semasa elektrolisis. |
| Anod | Elektrod yang disambungkan pada terminal positif sumber elektrik dalam sel elektrolitik. |
| Bukan elektrolit | Bahan yang tidak dapat mengalirkan arus elektrik dalam keadaan leburan atau akueus. |
| Elektrod | Konduktor elektrik yang disambungkan pada sumber elektrik dan membolehkan arus elektrik masuk atau keluar daripada elektrolit. |
| Elektrokimia | Kajian dalam bidang kimia tentang hubung kait antara fenomena elektrik dengan fenomena kimia. |
| Elektrolisis | Proses penguraian sesuatu sebatian dalam keadaan leburan atau akueus kepada unsur juzuknya apabila arus elektrik mengalir melaluinya. |
| Elektrolit | Bahan yang dapat mengalirkan arus elektrik dalam keadaan leburan atau akueus dan mengalami perubahan kimia. |
| Elektro-penggumpalan | Satu teknik untuk merawat air sisa yang mengaplikasikan proses elektrolisis dan penggumpalan untuk menyingkirkan bahan pencemar. |
| Flok | Gumpalan yang terbentuk daripada gabungan ion logam, ion hidroksida, dan bahan pencemar dalam air sisa semasa proses elektro-penggumpalan. |
| Kation | Ion yang bercas positif yang bergerak ke katod semasa elektrolisis. |
| Katod | Elektrod yang disambungkan pada terminal negatif sumber elektrik dalam sel elektrolitik. |
| Sel elektrolitik | Sel elektrokimia di mana arus elektrik digunakan untuk menghasilkan tindak balas kimia, menukarkan tenaga elektrik kepada tenaga kimia. |
| Sel kimia | Juga dikenali sebagai sel voltan atau sel galvani; sel elektrokimia di mana perubahan kimia menghasilkan arus elektrik, menukarkan tenaga kimia kepada tenaga elektrik. |
| Siri elektrokimia | Susunan ion-ion mengikut kecenderungannya untuk dinyahcas pada elektrod. Ion yang lebih rendah dalam siri lebih mudah dinyahcas. |
CONTOH SOALAN KBAT
Soalan dan Jawapan KBAT (Kemahiran Berfikir Aras Tinggi)
1. Soalan: Seorang pelajar ingin menyadur sebatang paku besi dengan kuprum untuk mengelakkannya daripada berkarat. Dengan menggunakan pengetahuan tentang sel elektrolitik, reka bentuk satu eksperimen ringkas untuk mencapai tujuan ini. Nyatakan bahan yang akan digunakan sebagai anod, katod, dan elektrolit.
Jawapan: Untuk menyadur paku besi dengan kuprum, proses elektrolisis boleh digunakan.
• Katod (Terminal Negatif): Paku besi yang hendak disadur. Ion kuprum(II) dari elektrolit akan dinyahcas di sini dan terenap sebagai lapisan kuprum tulen.
• Anod (Terminal Positif): Logam kuprum tulen. Kuprum di anod akan mengion dan larut ke dalam elektrolit untuk menggantikan ion kuprum(II) yang telah terenap di katod, seterusnya mengekalkan kepekatan elektrolit.
• Elektrolit: Larutan akueus yang mengandungi ion kuprum, seperti larutan kuprum(II) sulfat (CuSO₄).
2. Soalan: Berdasarkan gambar rajah eksperimen “sel kimia daripada ubi kentang” pada permulaan bab, terangkan bagaimana susunan radas tersebut mampu menyalakan mentol. Cadangkan satu cara untuk meningkatkan kecerahan nyalaan mentol tersebut.
Jawapan: Ubi kentang mengandungi jus berasid yang boleh bertindak sebagai elektrolit. Apabila dua logam berlainan (seperti paku besi dan rod kuprum) dicucuk ke dalam ubi kentang, satu sel kimia ringkas terbentuk. Logam yang lebih reaktif (besi) akan bertindak sebagai terminal negatif dan logam yang kurang reaktif (kuprum) sebagai terminal positif. Perbezaan keupayaan antara dua logam ini menyebabkan elektron mengalir dari besi ke kuprum melalui litar luar (wayar penyambung dan mentol), menghasilkan arus elektrik yang menyalakan mentol. Untuk meningkatkan kecerahan mentol, voltan perlu ditingkatkan. Ini boleh dicapai dengan menyambungkan beberapa sel ubi kentang secara bersiri, seperti yang ditunjukkan dalam gambar rajah di mana tiga biji ubi kentang disambungkan bersama.
3. Soalan: Dalam satu eksperimen elektrolisis larutan argentum nitrat, elektrod karbon digunakan. Ramalkan hasil yang akan terbentuk di anod dan katod, dan berikan justifikasi berdasarkan kedudukan ion dalam siri elektrokimia.
Jawapan: Ion-ion yang hadir dalam larutan ialah ion argentum (Ag⁺), ion nitrat (NO₃⁻), ion hidrogen (H⁺), dan ion hidroksida (OH⁻).
• Di Katod (Negatif): Kation Ag⁺ dan H⁺ akan ditarik ke katod. Berdasarkan siri elektrokimia, ion argentum (Ag⁺) berada di kedudukan yang lebih rendah daripada ion hidrogen (H⁺), menjadikannya kurang elektropositif dan lebih cenderung untuk dinyahcas. Oleh itu, pepejal argentum (perak) akan terenap pada katod.
• Di Anod (Positif): Anion OH⁻ dan NO₃⁻ akan ditarik ke anod. Berdasarkan siri elektrokimia, ion hidroksida (OH⁻) berada di kedudukan lebih rendah daripada ion nitrat (NO₃⁻), menjadikannya lebih cenderung untuk dinyahcas. Oleh itu, ion OH⁻ akan dinyahcas untuk menghasilkan gas oksigen dan air.
4. Soalan: Teknologi bateri ion litium adalah penting untuk kemajuan kereta elektrik. Mengapakah sifat seperti “kadar mengecas yang lebih tinggi” dan “ringan” dianggap sebagai ciri unggul untuk bateri kereta elektrik?
Jawapan:
• Kadar Mengecas yang Lebih Tinggi: Sifat ini amat penting untuk kemudahan pengguna. Ia memendekkan masa yang diperlukan untuk mengecas semula bateri kereta, menjadikan kereta elektrik lebih praktikal untuk perjalanan jauh dan mengurangkan masa menunggu di stesen pengecas. Ini menjadikan pengalaman pemilikan kereta elektrik setanding dengan mengisi minyak petrol konvensional.
• Ringan: Berat bateri memberi kesan langsung kepada kecekapan dan prestasi kenderaan. Bateri yang lebih ringan mengurangkan berat keseluruhan kereta, membolehkannya bergerak lebih jauh dengan sekali cas (jarak pemanduan lebih baik) dan memerlukan kurang tenaga untuk memecut. Ini meningkatkan kecekapan tenaga dan prestasi pemanduan secara keseluruhan.
5. Soalan: Proses elektro-penggumpalan diterangkan sebagai satu kaedah inovatif untuk merawat air sisa. Bandingkan keberkesanan proses ini jika anod aluminium digantikan dengan anod karbon.
Jawapan: Jika anod aluminium digantikan dengan anod karbon (elektrod lengai), proses elektro-penggumpalan tidak akan berlaku dengan berkesan. Dalam proses asal, anod aluminium memainkan peranan aktif dengan mengion untuk membentuk ion aluminium (Al³⁺). Ion-ion ini kemudiannya bertindak balas dengan ion hidroksida di dalam air untuk membentuk gumpalan (flok) aluminium hidroksida yang memerangkap bahan pencemar. Sebaliknya, anod karbon adalah lengai; ia tidak akan melarut atau mengion. Sebaliknya, ion negatif dalam air sisa (seperti ion hidroksida atau ion lain) akan dinyahcas di permukaan karbon, lazimnya menghasilkan gas. Tanpa pembentukan ion logam daripada anod, proses penggumpalan tidak akan berlaku, dan bahan pencemar tidak akan dapat diasingkan daripada air sisa dengan cara ini. Oleh itu, penggunaan anod logam yang aktif seperti aluminium adalah kritikal untuk kejayaan proses elektro-penggumpalan.
KOLEKSI LATIHAN
| LATIHAN | SKEMA |
