Nota Sains Tambahan Tingkatan 4 Bab 5: Ikatan Kimia
NOTA RINGKAS
1. Kestabilan Unsur (Gas Adi)
• Konsep Kestabilan: Atom berusaha untuk mencapai susunan elektron yang stabil. Gas adi (Kumpulan 18) adalah unsur yang stabil secara semula jadi.
• Susunan Elektron Stabil: Terdapat dua jenis susunan elektron yang stabil:
◦ Duplet: Mempunyai dua elektron valens (elektron di petala terluar). Contoh: Atom Helium (He).
◦ Oktet: Mempunyai lapan elektron valens. Contoh: Atom Neon (Ne) dan Argon (Ar).
• Ciri-ciri Gas Adi:
◦ Stabil: Telah mencapai susunan elektron duplet atau oktet.
◦ Lengai: Tidak reaktif dan tidak bertindak balas secara kimia dengan unsur lain.
◦ Monoatom: Wujud sebagai atom tunggal kerana tidak perlu membentuk ikatan.
2. Cara Unsur Lain Mencapai Kestabilan
Unsur-unsur selain gas adi mencapai kestabilan susunan elektron melalui dua cara utama:
1. Pendermaan dan Penerimaan Elektron (Ikatan Ion):
◦ Atom logam cenderung menderma elektron valens untuk membentuk ion positif (kation). Contoh: Natrium (Na) dengan susunan 2.8.1 menderma 1 elektron menjadi ion Na⁺ (susunan 2.8).
◦ Atom bukan logam cenderung menerima elektron untuk membentuk ion negatif (anion). Contoh: Fluorin (F) dengan susunan 2.7 menerima 1 elektron menjadi ion F⁻ (susunan 2.8).
2. Perkongsian Elektron (Ikatan Kovalen):
◦ Atom-atom bukan logam berkongsi elektron valens untuk mencapai susunan duplet atau oktet yang stabil. Contoh: Dua atom Klorin (Cl) dengan susunan 2.8.7 masing-masing berkongsi satu elektron untuk membentuk molekul Cl₂.
3. Ikatan Ion
• Pembentukan: Terbentuk melalui pemindahan elektron daripada atom logam kepada atom bukan logam. Daya tarikan elektrostatik yang kuat wujud antara ion positif dan ion negatif yang terbentuk.
• Contoh Pembentukan Sebatian Ion:
◦ Natrium Klorida (NaCl): Atom Natrium (Na) menderma 1 elektron kepada atom Klorin (Cl). Ion Na⁺ dan Cl⁻ terbentuk dan saling menarik.
◦ Magnesium Oksida (MgO): Atom Magnesium (Mg) menderma 2 elektron kepada atom Oksigen (O). Ion Mg²⁺ dan O²⁻ terbentuk dan saling menarik.
• Sifat Fizik Sebatian Ion:
◦ Kekonduksian Elektrik: Boleh mengkonduksikan elektrik dalam keadaan leburan dan larutan akueus, tetapi tidak dalam keadaan pepejal.
◦ Takat Lebur dan Didih: Mempunyai takat lebur dan takat didih yang tinggi.
◦ Keterlarutan: Lazimnya larut dalam air tetapi tidak larut dalam pelarut organik.
• Kegunaan dalam Kehidupan Harian:
◦ Natrium Klorida (NaCl): Bahan perasa dalam masakan.
◦ Magnesium Oksida (MgO): Bahan antasid untuk melegakan pedih hulu hati.
◦ Kalsium Oksida (CaO): Meneutralkan tanah yang berasid.
4. Ikatan Kovalen
• Pembentukan: Terbentuk apabila atom-atom bukan logam berkongsi elektron untuk mencapai susunan elektron duplet atau oktet yang stabil.
• Jenis Ikatan Kovalen:
◦ Ikatan Tunggal: Sepasang elektron dikongsi antara dua atom. Contoh: Molekul Hidrogen (H₂).
◦ Ikatan Ganda Dua: Dua pasang elektron dikongsi antara dua atom. Contoh: Molekul Oksigen (O₂).
• Contoh Pembentukan Sebatian Kovalen:
◦ Air (H₂O): Satu atom Oksigen berkongsi elektron dengan dua atom Hidrogen, membentuk dua ikatan kovalen tunggal.
• Sifat Fizik Sebatian Kovalen:
◦ Kekonduksian Elektrik: Tidak boleh mengkonduksikan elektrik dalam semua keadaan.
◦ Takat Lebur dan Didih: Mempunyai takat lebur dan takat didih yang rendah.
◦ Keterlarutan: Tidak larut dalam air tetapi larut dalam pelarut organik.
• Kegunaan dalam Kehidupan Harian:
◦ Alkohol (sejenis sebatian kovalen) digunakan sebagai pelarut.
◦ Digunakan dalam penghasilan cat, kosmetik, dan ubat-ubatan.
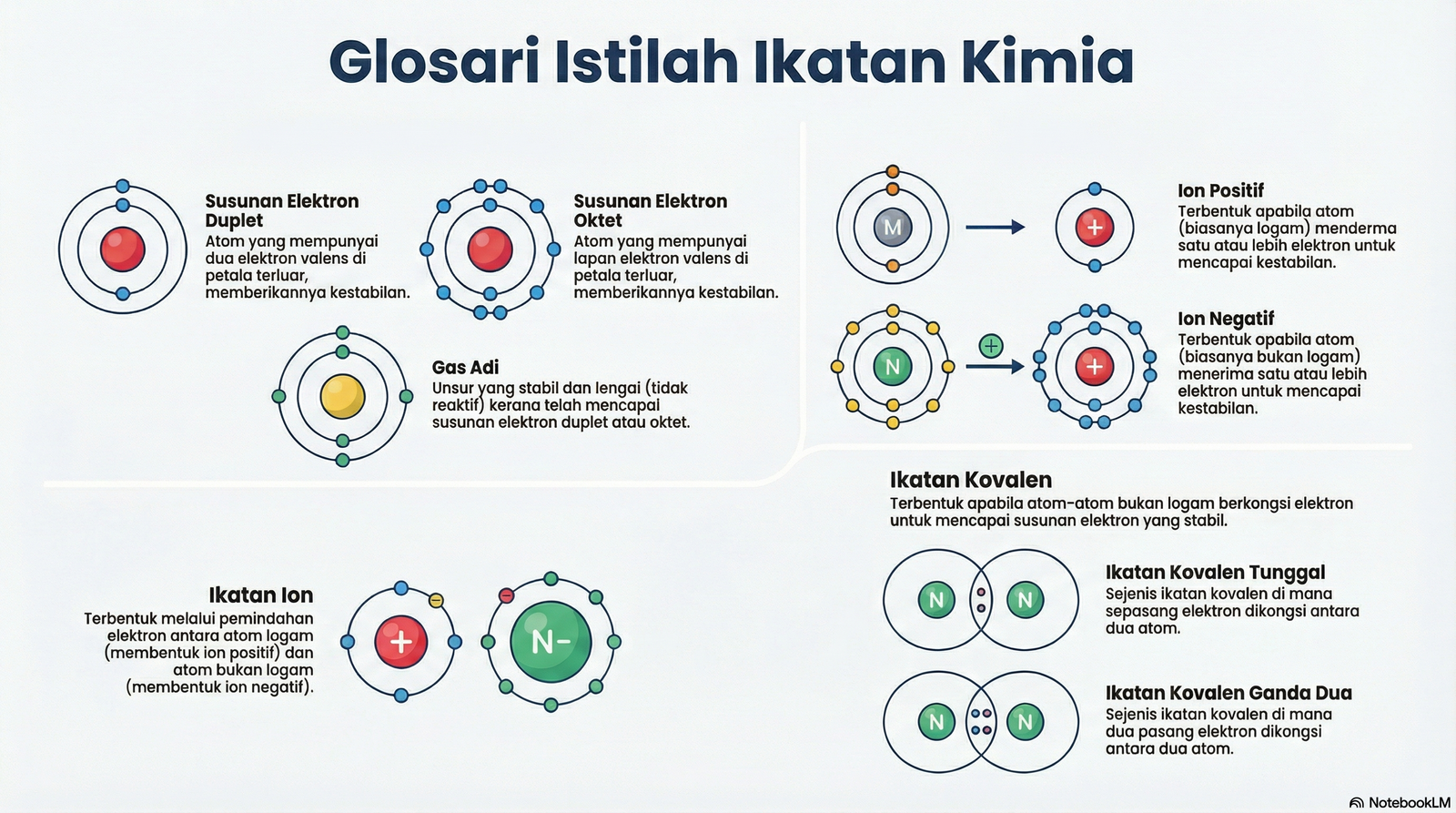
GLOSARI
| ISTILAH | DEFINISI |
|---|---|
| Duplet | Susunan elektron yang stabil di mana petala elektron terluar atom diisi dengan dua elektron. |
| Elektron valens | Elektron yang terletak di petala paling luar bagi sesuatu atom. |
| Gas adi | Unsur-unsur dalam Kumpulan 18 jadual berkala yang stabil secara kimia kerana mempunyai susunan elektron duplet atau oktet yang penuh. |
| Ikatan Ion | Ikatan kimia yang terbentuk hasil daripada daya tarikan elektrostatik antara ion bercas positif (kation) dan ion bercas negatif (anion) selepas pemindahan elektron berlaku. |
| Ikatan Kovalen | Ikatan kimia yang terbentuk apabila atom-atom bukan logam berkongsi satu atau lebih pasangan elektron untuk mencapai susunan elektron yang stabil. |
| Ikatan kovalen ganda dua | Ikatan kovalen yang terbentuk apabila dua atom berkongsi dua pasang elektron (empat elektron). |
| Ikatan kovalen tunggal | Ikatan kovalen yang terbentuk apabila dua atom berkongsi sepasang elektron (dua elektron). |
| Ion negatif (Anion) | Atom atau kumpulan atom yang telah menerima satu atau lebih elektron, menjadikannya bercas negatif. |
| Ion positif (Kation) | Atom atau kumpulan atom yang telah menderma (kehilangan) satu atau lebih elektron, menjadikannya bercas positif. |
| Lengai | Sifat suatu bahan kimia yang tidak reaktif atau tidak mudah bertindak balas secara kimia dengan bahan lain. |
| Monoatom | Terdiri daripada satu atom sahaja dan tidak terikat secara kimia dengan atom lain. |
| Oktet | Susunan elektron yang stabil di mana petala elektron terluar atom diisi dengan lapan elektron. |
| Susunan elektron | Perihal taburan atau kedudukan elektron dalam petala-petala yang mengelilingi nukleus sesuatu atom. |