Nota Sains Tambahan Tingkatan 4 Bab 6: Tenaga dan Perubahan Kimia
NOTA RINGKAS
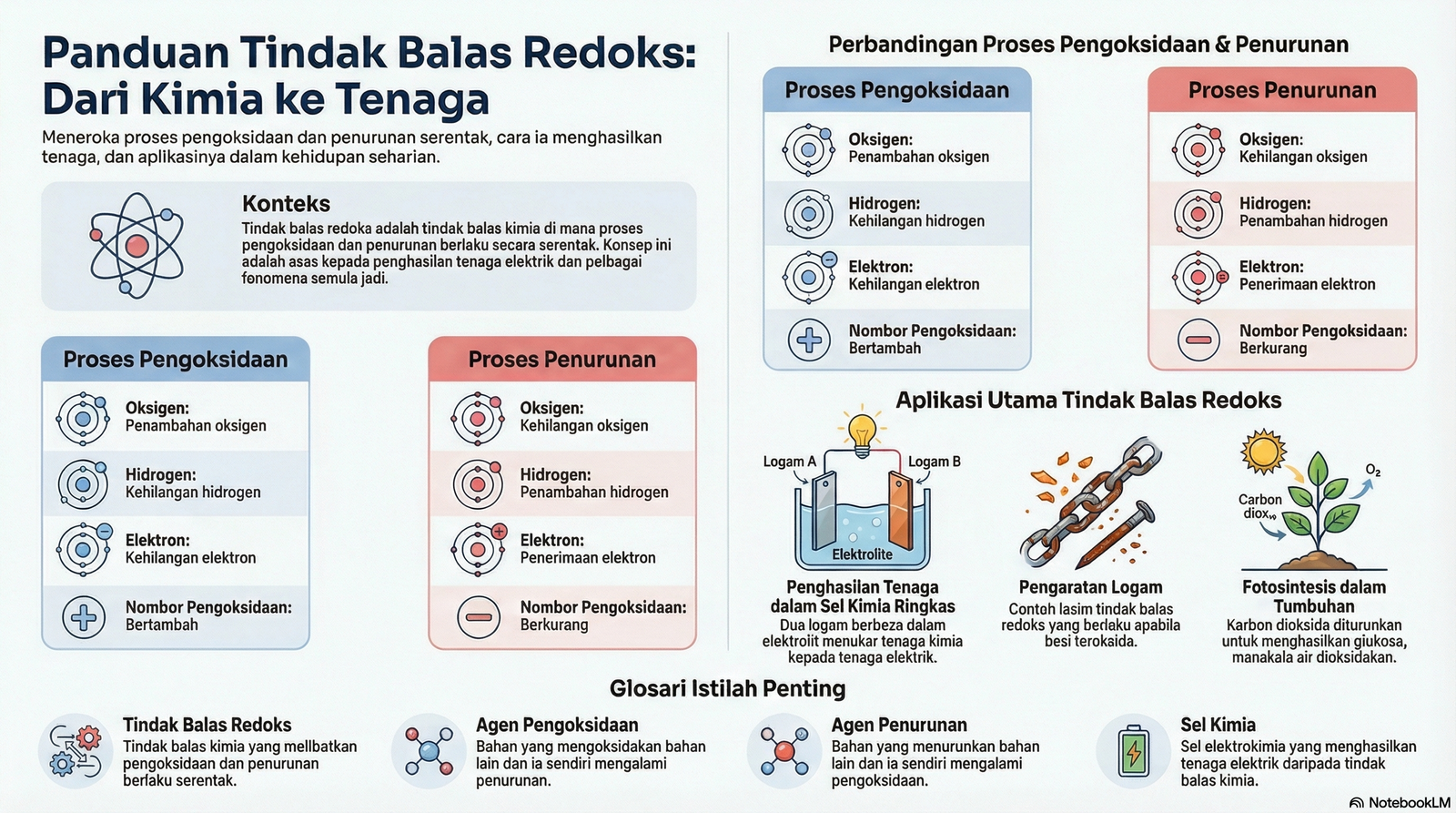
1. Proses Pengoksidaan dan Penurunan
Tindak balas kimia sering melibatkan pemindahan oksigen, hidrogen, atau elektron. Proses-proses ini ditakrifkan sebagai pengoksidaan dan penurunan.
| Kriteria | Proses Pengoksidaan | Proses Penurunan |
|---|---|---|
| Oksigen | Penambahan oksigen | Kehilangan oksigen |
| Hidrogen | Kehilangan hidrogen | Penambahan hidrogen |
| Elektron | Kehilangan elektron | Penerimaan elektron |
| Nombor Pengoksidaan | Bertambah | Berkurang |
• Agen Pengoksidaan: Bahan yang mengoksidakan bahan lain dan ia sendiri diturunkan dalam tindak balas kimia.
• Agen Penurunan: Bahan yang menurunkan bahan lain dan ia sendiri dioksidakan dalam tindak balas kimia.
• Contoh: Dalam tindak balas 2Mg + O2 → 2MgO, Magnesium (Mg) ialah agen penurunan kerana ia dioksidakan (kehilangan elektron), manakala Oksigen (O2) ialah agen pengoksidaan kerana ia diturunkan (menerima elektron).
2. Sel Kimia Ringkas
Sel kimia ialah sel elektrokimia yang menukarkan tenaga kimia kepada tenaga elektrik melalui tindak balas kimia.
• Komponen: Terdiri daripada dua jenis logam berbeza (elektrod) yang dicelup ke dalam larutan (elektrolit) dan disambung oleh litar luar.
• Penentuan Terminal:
◦ Terminal Negatif (Anod): Logam yang berada pada kedudukan lebih tinggi dalam siri elektrokimia. Ia cenderung menderma elektron (mengalami pengoksidaan).
◦ Terminal Positif (Katod): Logam yang berada pada kedudukan lebih rendah dalam siri elektrokimia. Ia cenderung menerima elektron, di mana ion positif dalam elektrolit akan menerima elektron (mengalami penurunan).
• Siri Elektrokimia: Susunan logam berdasarkan kecenderungan untuk menderma elektron. (K, Na, Ca, Mg, Al, Zn, Fe, Sn, Pb, Cu, Ag).
• Penghasilan Elektrik: Elektron mengalir dari anod ke katod melalui litar luar, menghasilkan arus elektrik. Arus elektrik mengalir pada arah yang bertentangan dengan aliran elektron.
3. Tindak Balas Redoks
Tindak balas redoks (gabungan REDuction dan OXidation) ialah tindak balas kimia di mana proses penurunan dan pengoksidaan berlaku serentak.
• Konsep: Melibatkan pemindahan elektron. Satu bahan kehilangan elektron (pengoksidaan) manakala bahan lain menerima elektron tersebut (penurunan).
• Contoh Tindak Balas Redoks:
◦ Pengaratan logam
◦ Pembakaran logam
◦ Pengekstrakan logam (cth: bijih timah)
◦ Elektrokimia (cth: sel kimia dan elektrolisis)
◦ Tindak balas penyesaran logam
◦ Fotosintesis
• Kegunaan dalam Kehidupan Harian:
◦ Pengekstrakan Bijih Timah: Karbon digunakan sebagai agen penurunan untuk menurunkan stanum(IV) oksida kepada logam stanum.
◦ Penyaduran Logam: Melindungi logam seperti sudu besi daripada berkarat dan menjadikannya lebih menarik secara estetik.
◦ Fotosintesis: Tumbuhan menggunakan cahaya matahari untuk menukar karbon dioksida dan air kepada glukosa dan oksigen. Ini melibatkan penurunan karbon dioksida dan pengoksidaan air.
GLOSARI
Glosari Istilah Penting
| ISTILAH | DEFINISI |
|---|---|
| Agen Pengoksidaan | Bahan yang mengoksidakan bahan lain dan diturunkan dalam tindak balas kimia. |
| Agen Penurunan | Bahan yang menurunkan bahan lain dan dioksidakan dalam tindak balas kimia. |
| Anod | Terminal negatif dalam sel kimia, di mana proses pengoksidaan (kehilangan elektron) berlaku. |
| Elektrod | Logam-logam yang disambung dengan wayar penyambung dalam sebuah sel kimia. |
| Elektrolit | Larutan yang membenarkan pengaliran ion, melengkapkan litar dalam sel kimia. |
| Katod | Terminal positif dalam sel kimia, di mana proses penurunan (penerimaan elektron) berlaku. |
| Pengoksidaan | Proses yang melibatkan penambahan oksigen, kehilangan hidrogen, kehilangan elektron, atau pertambahan nombor pengoksidaan. |
| Pengaratan | Satu contoh tindak balas pengoksidaan dan penurunan, juga dikenali sebagai tindak balas redoks. |
| Penurunan | Proses yang melibatkan kehilangan oksigen, penambahan hidrogen, penerimaan elektron, atau pengurangan nombor pengoksidaan. |
| Sel Kimia Ringkas | Sel elektrokimia yang menghasilkan tenaga elektrik daripada tindak balas kimia, terdiri daripada dua logam berbeza dalam satu elektrolit. |
| Siri Elektrokimia | Susunan logam mengikut keupayaan mereka untuk menderma elektron. Logam yang lebih tinggi lebih mudah menderma elektron. |
| Tindak Balas Redoks | Tindak balas kimia di mana proses pengoksidaan dan penurunan berlaku secara serentak. |