Nota Sains Tingkatan 4 Bab 8: Unsur Dan Bahan
RINGKASAN
Ringkasan Bab (Nota Sains Tingkatan 4 Bab 8: Unsur Dan Bahan)
Bab ini membincangkan konsep asas jirim, pengelasan unsur dalam Jadual Berkala Unsur Moden, dan pengenalan kepada isotop serta kegunaannya.
1. Asas Jirim
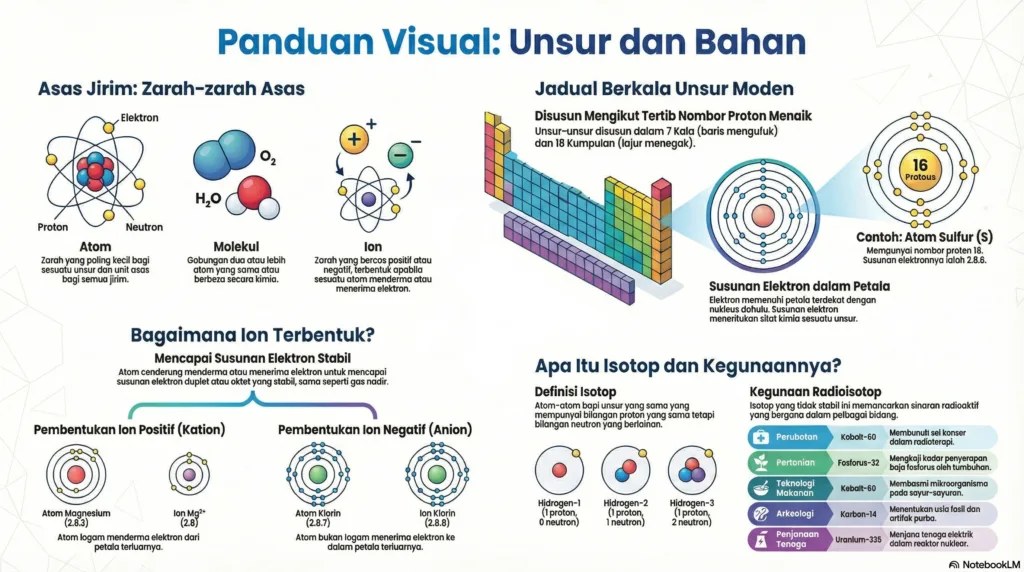
Semua bahan di sekeliling kita adalah jirim. Jirim terdiri daripada zarah-zarah yang halus dan diskrit. Terdapat tiga jenis zarah asas yang membina jirim:
• Atom: Merupakan zarah yang paling kecil di dalam sesuatu unsur dan unit asas bagi unsur tersebut. Atom terdiri daripada zarah subatom iaitu proton, neutron, dan elektron.
◦ Bahan Atom: Bahan yang mengandungi zarah atom sahaja. Contohnya, semua unsur logam seperti emas (logam emas) dan gas nadir seperti helium (belon berisi helium) terdiri daripada atom.
• Molekul: Gabungan dua atau lebih atom secara kimia. Gabungan ini boleh melibatkan atom yang sama atau berbeza.
◦ Bahan Molekul: Bahan yang mengandungi zarah molekul. Kebanyakannya terbentuk daripada tindak balas antara unsur bukan logam. Contohnya, gas oksigen (molekul oksigen) dan air laut (molekul air).
• Ion: Zarah yang bercas, sama ada positif atau negatif. Ion terbentuk apabila sesuatu atom menderma atau menerima elektron.
◦ Bahan Ion: Bahan yang terbentuk daripada tindak balas antara unsur logam dengan unsur bukan logam. Ia mengandungi ion positif dan ion negatif. Contohnya ialah garam biasa (natrium klorida).
Sesuatu unsur boleh wujud dalam pelbagai bentuk zarah. Contohnya, unsur ferum wujud sebagai atom dalam tukul tetapi wujud sebagai ion dalam sebatian karat. Unsur hidrogen wujud sebagai ion dalam jus limau dan sebagai molekul dalam udara.
2. Jadual Berkala Unsur Moden
Jadual Berkala Unsur Moden menyusun 118 unsur yang diketahui.
• Struktur: Terdapat 18 lajur menegak yang dipanggil Kumpulan dan 7 baris mengufuk yang dipanggil Kala.
• Prinsip Susunan: Unsur-unsur disusun mengikut tertib menaik nombor proton dari kiri ke kanan dan dari atas ke bawah.
• Pengelasan Unsur: Unsur dikelaskan kepada logam, separuh logam, dan bukan logam. Terdapat juga kumpulan khas seperti halogen dan gas nadir.
• Sifat Merentasi Kala: Apabila merentasi kala dari kiri ke kanan:
◦ Sifat logam berkurang manakala sifat bukan logam meningkat.
◦ Sifat oksida berubah daripada bes kepada asid.
◦ Sifat kekonduksian arus elektrik semakin berkurangan.
3. Susunan Elektron dan Pembentukan Ion
• Susunan Elektron: Elektron dalam atom disusun dalam petala-petala mengelilingi nukleus. Petala pertama boleh diisi dengan maksimum 2 elektron, manakala petala kedua boleh diisi dengan maksimum 8 elektron.
• Kestabilan: Atom cenderung untuk mencapai susunan elektron duplet (2 elektron pada petala pertama) atau oktet (8 elektron pada petala terluar) yang stabil.
• Pembentukan Ion: Untuk mencapai kestabilan, atom boleh menderma atau menerima elektron.
◦ Ion Positif: Terbentuk apabila atom unsur logam menderma elektron dari petala terluarnya. Contoh: Atom magnesium (2.8.2) menderma 2 elektron membentuk ion Mg²⁺ (2.8).
◦ Ion Negatif: Terbentuk apabila atom unsur bukan logam menerima elektron ke dalam petala terluarnya. Contoh: Atom klorin (2.8.7) menerima 1 elektron membentuk ion Cl⁻ (2.8.8).
4. Isotop
• Definisi: Isotop ialah atom-atom bagi unsur yang sama yang mempunyai bilangan proton yang sama tetapi bilangan neutron yang berlainan. Ini menyebabkan isotop mempunyai nombor proton yang sama tetapi nombor nukleon yang berbeza.
• Contoh: Hidrogen-1, Hidrogen-2, dan Hidrogen-3 adalah isotop bagi hidrogen. Karbon-12 dan Karbon-14 adalah isotop bagi karbon.
• Radioisotop: Isotop yang tidak stabil dan memancarkan sinaran radioaktif.
• Kegunaan Isotop: Radioisotop mempunyai pelbagai kegunaan dalam pelbagai bidang.
| Bidang | Isotop | Kegunaan |
| Perubatan | Kobalt-60 | Sinar gama digunakan untuk membunuh sel kanser (radioterapi). |
| Iodin-131 | Merawat penyakit tiroid. | |
| Natrium-24 | Mengesan lokasi pembekuan darah. | |
| Pertanian | Fosforus-32 | Mengkaji kadar penyerapan baja fosforus oleh tumbuhan. |
| Karbon-14 | Mengkaji proses fotosintesis. | |
| Teknologi Makanan | Kobalt-60 | Membunuh mikroorganisma dalam makanan untuk mengawetnya. |
| Arkeologi & Geologi | Karbon-14 | Menentukan usia artifak atau fosil purba (pentarikhan karbon). |
| Industri | Amerisium-241 | Mengawal ketebalan kertas dalam industri kertas. |
| Penjanaan Tenaga | Uranium-235 | Sebagai bahan api dalam reaktor nuklear untuk menjana tenaga elektrik. |
GLOSARI
| Istilah | Definisi |
| Atom | Zarah yang paling kecil di dalam sesuatu unsur; unit paling asas dalam unsur. |
| Bahan Atom | Bahan yang hanya mengandungi zarah jenis atom. |
| Bahan Ion | Bahan yang mengandungi ion positif dan ion negatif, terbentuk daripada tindak balas logam dan bukan logam. |
| Bahan Molekul | Bahan yang hanya mengandungi zarah jenis molekul. |
| Elektron | Zarah subatom yang bercas negatif dan mengelilingi nukleus dalam petala. |
| Ion | Zarah yang bercas (positif atau negatif) yang terbentuk apabila atom menderma atau menerima elektron. |
| Ion Negatif | Zarah bercas negatif yang terbentuk apabila atom (biasanya bukan logam) menerima elektron. |
| Ion Positif | Zarah bercas positif yang terbentuk apabila atom (biasanya logam) menderma elektron. |
| Isotop | Atom-atom bagi unsur yang sama yang mempunyai bilangan proton yang sama tetapi bilangan neutron yang berlainan. |
| Jadual Berkala Unsur Moden | Carta yang menyusun semua unsur yang diketahui mengikut tertib menaik nombor proton. |
| Kala | Baris mengufuk dalam Jadual Berkala Unsur Moden. |
| Kumpulan | Lajur menegak dalam Jadual Berkala Unsur Moden. |
| Molekul | Gabungan dua atau lebih atom secara kimia. |
| Neutron | Zarah subatom yang tidak bercas (neutral) dan berada di dalam nukleus atom. |
| Nombor Nukleon | Jumlah bilangan proton dan neutron di dalam nukleus sesuatu atom. |
| Nombor Proton | Bilangan proton di dalam nukleus sesuatu atom. |
| Petala Elektron | Aras tenaga tertentu di sekeliling nukleus di mana elektron bergerak. |
| Proton | Zarah subatom yang bercas positif dan berada di dalam nukleus atom. |
| Radioisotop | Isotop yang tidak stabil dan memancarkan sinaran radioaktif. |
| Susunan Elektron Duplet | Susunan elektron yang stabil dengan dua elektron pada petala pertama (petala terluar). |
| Susunan Elektron Oktet | Susunan elektron yang stabil dengan lapan elektron pada petala terluar. |
CONTOH SOALAN KBAT
Soalan Kemahiran Berfikir Aras Tinggi (KBAT)
1. Atom natrium (nombor proton 11) bertindak balas dengan atom klorin (nombor proton 17) untuk membentuk garam biasa. Terangkan proses pendermaan dan penerimaan elektron antara kedua-dua atom ini untuk mencapai susunan elektron yang stabil.
2. Unsur ferum boleh wujud dalam bentuk atom dalam sebatang tukul dan dalam bentuk ion dalam sebatian karat. Bandingkan susunan zarah dan sifat fizikal ferum dalam kedua-dua keadaan ini.
3. Karbon-14 dan Karbon-12 kedua-duanya ialah unsur karbon. Mengapakah Karbon-14 bersifat radioaktif dan digunakan dalam pentarikhan arkeologi, manakala Karbon-12 adalah stabil? Kaitkan jawapan anda dengan definisi isotop dan zarah subatom.
4. Seorang petani mendapati tanamannya tidak tumbuh dengan subur walaupun baja telah ditaburkan. Cadangkan bagaimana isotop Fosforus-32 boleh digunakan untuk membantu petani tersebut mengenal pasti masalah dan menyelesaikannya.
5. Dengan merujuk kepada Jadual Berkala Unsur Moden, jelaskan mengapa unsur dalam Kumpulan 1 (logam alkali) sangat cenderung untuk membentuk ion positif, manakala unsur dalam Kumpulan 17 (halogen) sangat cenderung untuk membentuk ion negatif.
——————————————————————————–
Jawapan KBAT
1. Atom natrium mempunyai susunan elektron 2.8.1. Untuk mencapai susunan elektron oktet yang stabil, ia cenderung untuk menderma 1 elektron pada petala terluarnya. Apabila ia menderma elektron, ia membentuk ion natrium (Na⁺) yang bercas positif dengan susunan elektron 2.8. Atom klorin pula mempunyai susunan elektron 2.8.7. Untuk mencapai susunan elektron oktet yang stabil, ia cenderung untuk menerima 1 elektron ke dalam petala terluarnya. Apabila ia menerima elektron, ia membentuk ion klorida (Cl⁻) yang bercas negatif dengan susunan elektron 2.8.8. Daya tarikan elektrostatik antara ion Na⁺ dan ion Cl⁻ membentuk sebatian ionik natrium klorida.
2. Dalam sebatang tukul, unsur ferum wujud sebagai bahan atom. Atom-atom ferum tersusun secara rapat dan teratur dalam struktur kekisi logam. Ini memberikannya sifat fizikal yang kuat, keras, dan boleh ditempa. Dalam sebatian karat, ferum wujud sebagai ion ferum dalam bahan ion. Ion-ion ini bercampur dengan ion lain (seperti ion oksida) dalam struktur yang rapuh dan berbeza sama sekali daripada logam asalnya. Karat tidak lagi mempunyai sifat kekilauan, kekuatan, dan kekonduksian elektrik seperti logam ferum.
3. Kedua-dua Karbon-14 dan Karbon-12 adalah isotop karbon kerana mempunyai bilangan proton yang sama (6 proton) tetapi bilangan neutron yang berbeza. Karbon-12 mempunyai 6 neutron (nombor nukleon 12), manakala Karbon-14 mempunyai 8 neutron (nombor nukleon 14). Perbezaan bilangan neutron ini menyebabkan nukleus Karbon-14 tidak stabil. Untuk menjadi stabil, nukleus Karbon-14 mereput dan memancarkan sinaran radioaktif. Sifat radioaktif dan kadar reputannya yang tetap inilah yang membolehkannya digunakan untuk menentukan usia bahan organik dalam pentarikhan arkeologi.
4. Isotop Fosforus-32 boleh digunakan sebagai penyurih radioaktif. Sedikit baja fosfat yang mengandungi Fosforus-32 disuntik ke dalam akar tumbuhan atau ditabur pada tanah di sekelilingnya. Selepas satu tempoh masa, bahagian-bahagian tumbuhan seperti daun dan batang diimbas menggunakan pengesan sinaran radioaktif. Jika bacaan sinaran sangat rendah atau tiada, ini menunjukkan bahawa tumbuhan tersebut gagal menyerap baja dari tanah dengan berkesan. Ini mungkin disebabkan oleh masalah pada akar tumbuhan atau keadaan tanah yang tidak sesuai. Dengan maklumat ini, petani boleh mengambil tindakan pembetulan seperti merawat tanah atau sistem pengairan.
5. Unsur dalam Kumpulan 1 mempunyai satu elektron sahaja di petala terluar (elektron valens). Adalah lebih mudah dari segi tenaga untuk atom-atom ini menderma satu elektron tersebut bagi mencapai susunan elektron oktet yang stabil pada petala sebelumnya. Oleh itu, mereka sangat mudah membentuk ion bercas +1. Sebaliknya, unsur dalam Kumpulan 17 mempunyai tujuh elektron valens. Adalah lebih mudah dari segi tenaga bagi atom-atom ini untuk menerima satu elektron bagi melengkapkan petala terluarnya menjadi lapan (oktet). Oleh itu, mereka sangat cenderung untuk membentuk ion bercas -1.
