Nota Sains Tambahan Tingkatan 4 Bab 4: Stoikiometri
NOTA RINGKAS
1. Jisim Atom Relatif, Jisim Molekul Relatif dan Jisim Formula Relatif
• Jisim Atom Relatif (JAR): Oleh kerana atom terlalu kecil untuk ditimbang secara langsung, jisimnya dibandingkan secara relatif dengan atom piawai. Jisim atom relatif suatu unsur ditakrifkan sebagai jisim purata satu atom unsur tersebut berbanding dengan 1/12 kali jisim satu atom karbon-12.
◦ Formula: Jisim atom relatif (JAR) = (Jisim satu atom bagi suatu unsur) / (1/12 × Jisim satu atom karbon-12)
• Jisim Molekul Relatif (JMR): JMR dihitung dengan menjumlahkan jisim atom relatif (JAR) bagi semua atom yang membentuk sesuatu molekul. Contohnya, JMR bagi air (H₂O) ialah (2 × JAR H) + (1 × JAR O).
• Jisim Formula Relatif (JFR): JFR digunakan untuk sebatian ion (bukan molekul), seperti natrium klorida (NaCl). Pengiraannya adalah sama seperti JMR, iaitu dengan menjumlahkan JAR bagi semua ion dalam unit formula.
• Fakta Penting: JAR, JMR, dan JFR tidak mempunyai unit.
2. Konsep Mol
• Mol: Mol ialah unit SI bagi kuantiti bahan. Ia digunakan untuk menyukat kuantiti atom, molekul, atau ion.
◦ Definisi: 1 mol sesuatu bahan ialah kuantiti yang mengandungi bilangan zarah yang sama dengan bilangan atom yang terdapat dalam 12 g karbon-12.
• Pemalar Avogadro (NA): Ini ialah bilangan zarah (atom, molekul, atau ion) yang terkandung di dalam satu mol bahan.
◦ Nilai: NA = 6.02 × 10²³ mol⁻¹
• Jisim Molar: Jisim molar ialah jisim bagi satu mol sesuatu bahan. Unitnya ialah gram per mol (g mol⁻¹). Nilai jisim molar bagi suatu unsur adalah sama secara numerik dengan jisim atom relatifnya.
• Hubungan Penting:
◦ Bilangan mol = Jisim bahan / Jisim molar
◦ Bilangan zarah = Bilangan mol × Pemalar Avogadro (NA)
3. Formula Kimia
• Pembentukan Ion: Atom cenderung untuk mencapai susunan elektron duplet (2 elektron valens) atau oktet (8 elektron valens) yang stabil.
◦ Ion Positif (Kation): Atom logam (Kumpulan 1, 2, 13) cenderung menderma elektron untuk membentuk ion positif. Contoh: Na → Na⁺ + e⁻.
◦ Ion Negatif (Anion): Atom bukan logam (Kumpulan 16, 17) cenderung menerima elektron untuk membentuk ion negatif. Contoh: Cl + e⁻ → Cl⁻.
• Menulis Formula Kimia: Formula kimia bagi sebatian ion ditulis dengan menyeimbangkan jumlah cas positif dan negatif supaya sebatian yang terbentuk adalah neutral. Ia menunjukkan simbol unsur dan nisbah atom bagi setiap unsur dalam sebatian.
4. Konsep Mol dalam Persamaan Kimia
• Persamaan Kimia Seimbang: Persamaan kimia mesti seimbang, iaitu bilangan atom bagi setiap unsur di sebelah bahan tindak balas mesti sama dengan bilangan atom di sebelah hasil tindak balas.
• Stoikiometri: Stoikiometri ialah kajian perhubungan kuantitatif antara bahan tindak balas dengan hasil tindak balas dalam sesuatu tindak balas kimia. Pekali dalam persamaan kimia yang seimbang menunjukkan nisbah mol bahan-bahan yang terlibat.
◦ Contoh: 2Zn + O₂ → 2ZnO. Ini bermakna 2 mol zink bertindak balas dengan 1 mol gas oksigen untuk menghasilkan 2 mol zink oksida.
5. Larutan Piawai
• Larutan Piawai: Ia adalah larutan yang kepekatannya diketahui dengan tepat.
• Kepekatan (Kemolaran): Kepekatan larutan piawai biasanya diukur dalam unit mol dm⁻³, dengan simbol M.
◦ Formula Kepekatan = Bilangan mol zat terlarut (mol) / Isi padu larutan (dm³)
• Kaedah Pencairan: Ini adalah kaedah untuk menyediakan larutan yang lebih cair daripada larutan stok (larutan pekat) dengan menambahkan pelarut (cth: air suling). Bilangan mol zat terlarut tidak berubah semasa pencairan.
◦ Formula Pencairan: M₁V₁ = M₂V₂
▪ M₁ = Kepekatan larutan sebelum pencairan
▪ V₁ = Isi padu larutan sebelum pencairan
▪ M₂ = Kepekatan larutan selepas pencairan
▪ V₂ = Isi padu larutan selepas pencairan
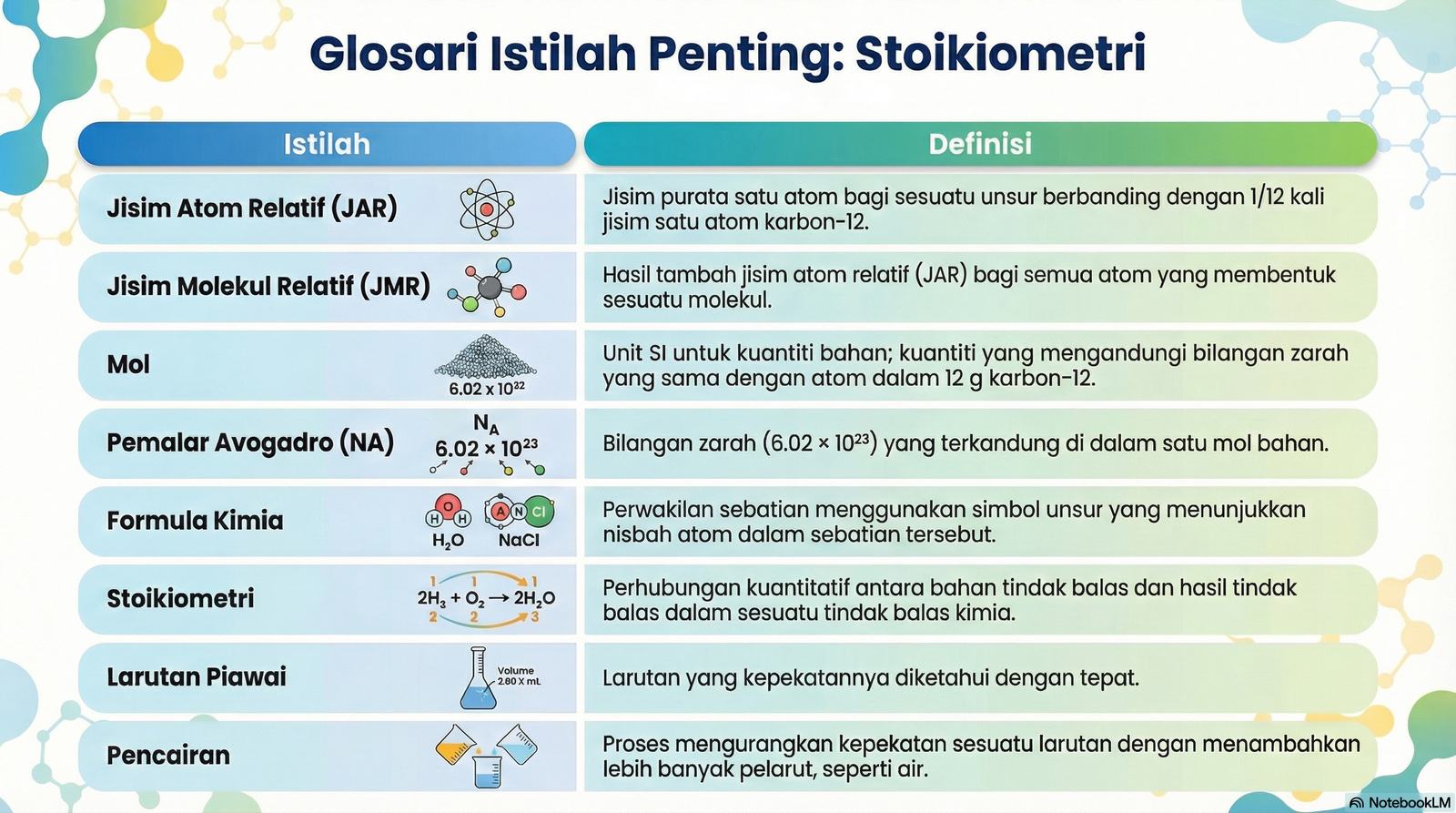
GLOSARI
| ISTILAH | DEFINISI |
|---|---|
| Atom | Zarah terkecil bagi sesuatu unsur. |
| Duplet | Susunan elektron yang stabil dengan dua elektron di petala terluar. |
| Formula Kimia | Perwakilan sebatian kimia yang menggunakan simbol unsur untuk menunjukkan jenis-jenis unsur dan nombor subskrip untuk menunjukkan bilangan atom bagi setiap unsur. |
| Ion | Zarah bercas yang terbentuk apabila suatu atom menderma atau menerima elektron. |
| Ion Negatif (Anion) | Terbentuk apabila atom bukan logam menerima satu atau lebih elektron. |
| Ion Positif (Kation) | Terbentuk apabila atom logam menderma satu atau lebih elektron. |
| Jisim Atom Relatif (JAR) | Jisim purata satu atom suatu unsur berbanding dengan 1/12 kali jisim satu atom karbon-12. |
| Jisim Formula Relatif (JFR) | Jumlah jisim atom relatif bagi semua atom dalam satu unit formula bagi sebatian ion. |
| Jisim Molar | Jisim bagi satu mol sesuatu bahan, diukur dalam unit g mol⁻¹. |
| Jisim Molekul Relatif (JMR) | Jumlah jisim atom relatif bagi semua atom dalam satu molekul. |
| Kepekatan | Kuantiti zat terlarut yang larut dalam sejumlah pelarut atau larutan yang tertentu. |
| Kemolaran (M) | Unit kepekatan yang mentakrifkan bilangan mol zat terlarut per desimeter padu (dm³) larutan. |
| Larutan Piawai | Larutan yang kepekatannya diketahui dengan tepat. |
| Mol | Unit SI untuk kuantiti bahan. Satu mol bahan mengandungi 6.02 × 10²³ zarah. |
| Molekul | Gabungan dua atau lebih atom. |
| Oktet | Susunan elektron yang stabil dengan lapan elektron di petala terluar. |
| Pekali | Angka yang ditulis di hadapan formula kimia dalam persamaan kimia untuk menyeimbangkannya. |
| Pemalar Avogadro (NA) | Bilangan zarah dalam satu mol bahan, iaitu 6.02 × 10²³ mol⁻¹. |
| Pencairan | Proses mengurangkan kepekatan sesuatu larutan dengan menambahkan lebih banyak pelarut. |
| Persamaan Kimia | Perwakilan tindak balas kimia menggunakan formula kimia, di mana bahan tindak balas ditulis di sebelah kiri dan hasil tindak balas di sebelah kanan. |
| Stoikiometri | Kajian hubungan kuantitatif (nisbah mol) antara bahan tindak balas dan hasil tindak balas dalam tindak balas kimia. |
| Zarah | Istilah umum yang merujuk kepada atom, molekul atau ion. |