Glosari SPM Kimia – Tingkatan 4 bab 5
Glosari Kimia Pro
Akses pantas istilah Bab 3, 4, dan 5
Formula Empirik
Formula yang menunjukkan nisbah paling ringkas bilangan atom setiap unsur dalam sebatian.
Isi Padu Molar
Isi padu bagi 1 mol sebarang gas pada suhu dan tekanan tertentu.
Jisim Molar
Jisim bagi satu mol sesuatu bahan dalam unit gram per mol.
Mol
Unit antarabangsa untuk kuantiti bahan yang mengandungi bilangan zarah yang sangat banyak.
Pemalar Avogadro
Bilangan zarah yang terkandung dalam satu mol bahan.
Elektron Valens
Elektron yang berada di petala paling luar sesuatu atom.
Gas Adi
Unsur Kumpulan 18 yang tidak reaktif kerana mempunyai petala valens yang penuh.
Unsur Peralihan
Unsur yang boleh membentuk ion berwarna dan bertindak sebagai mangkin.
Anion
Ion bercas negatif yang terbentuk apabila atom bukan logam menerima elektron.
Kation
Ion bercas positif yang terbentuk apabila atom logam menderma elektron valens.
Daya Elektrostatik
Daya tarikan yang kuat antara ion-ion yang berlainan cas dalam ikatan ion.
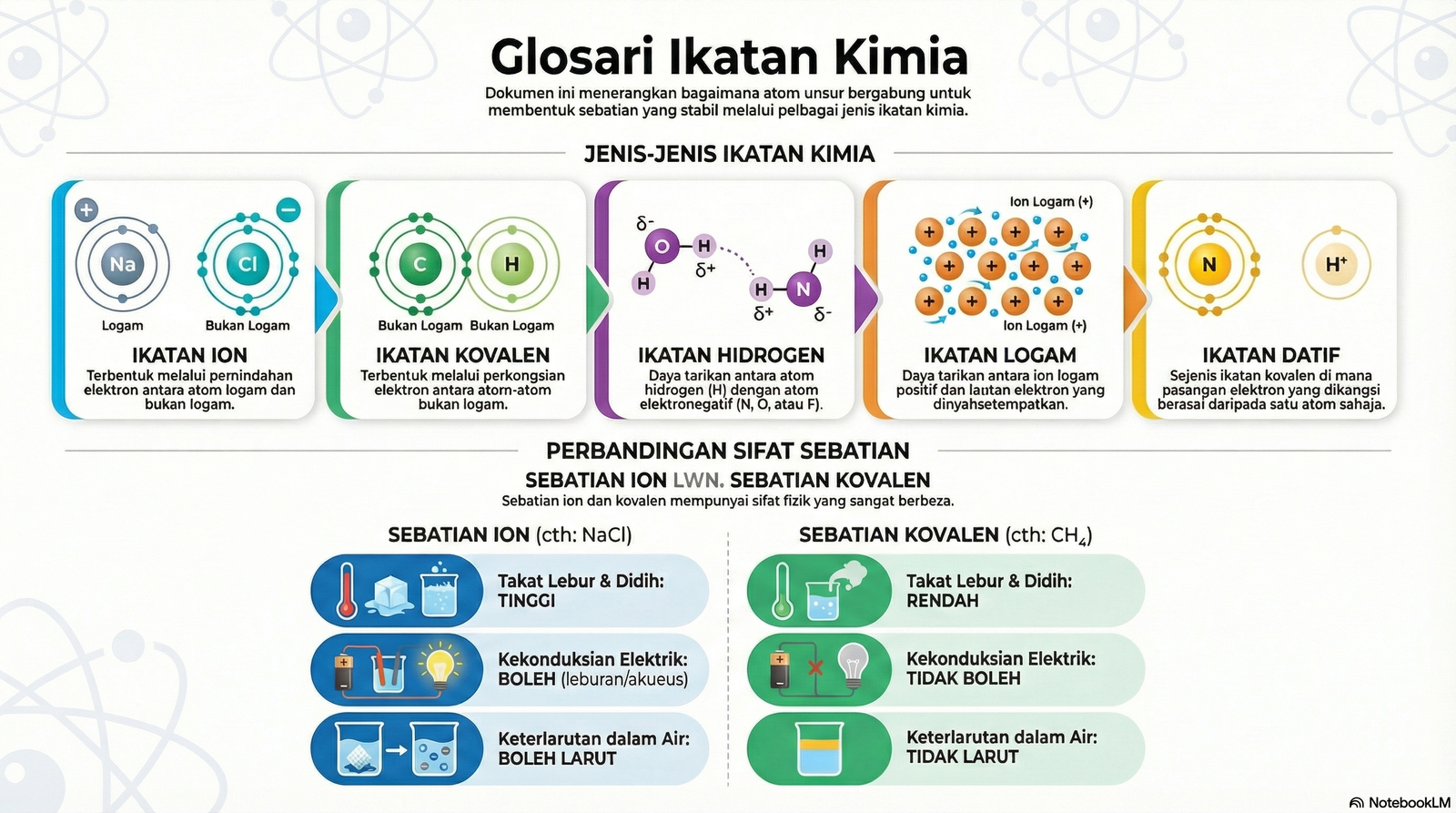
Ikatan Datif
Ikatan kovalen di mana pasangan elektron yang dikongsi berasal daripada satu atom sahaja.
Ikatan Hidrogen
Daya tarikan antara atom H dengan atom yang tinggi keelektronegatifan (N, O, F).
Lautan Elektron
Elektron valens yang dinyahsetempatkan dan bebas bergerak dalam struktur logam.
Molekul Gergasi
Struktur sebatian kovalen yang sangat besar seperti berlian atau silikon dioksida.
Struktur Lewis
Perwakilan yang menunjukkan elektron valens bagi atom yang terlibat dalam ikatan.