Nota Kimia Tingkatan 5 Bab 1: Keseimbangan Redoks
RINGKASAN
Ringkasan Komprehensif (Nota Kimia Tingkatan 5 Bab 1: Keseimbangan Redoks)
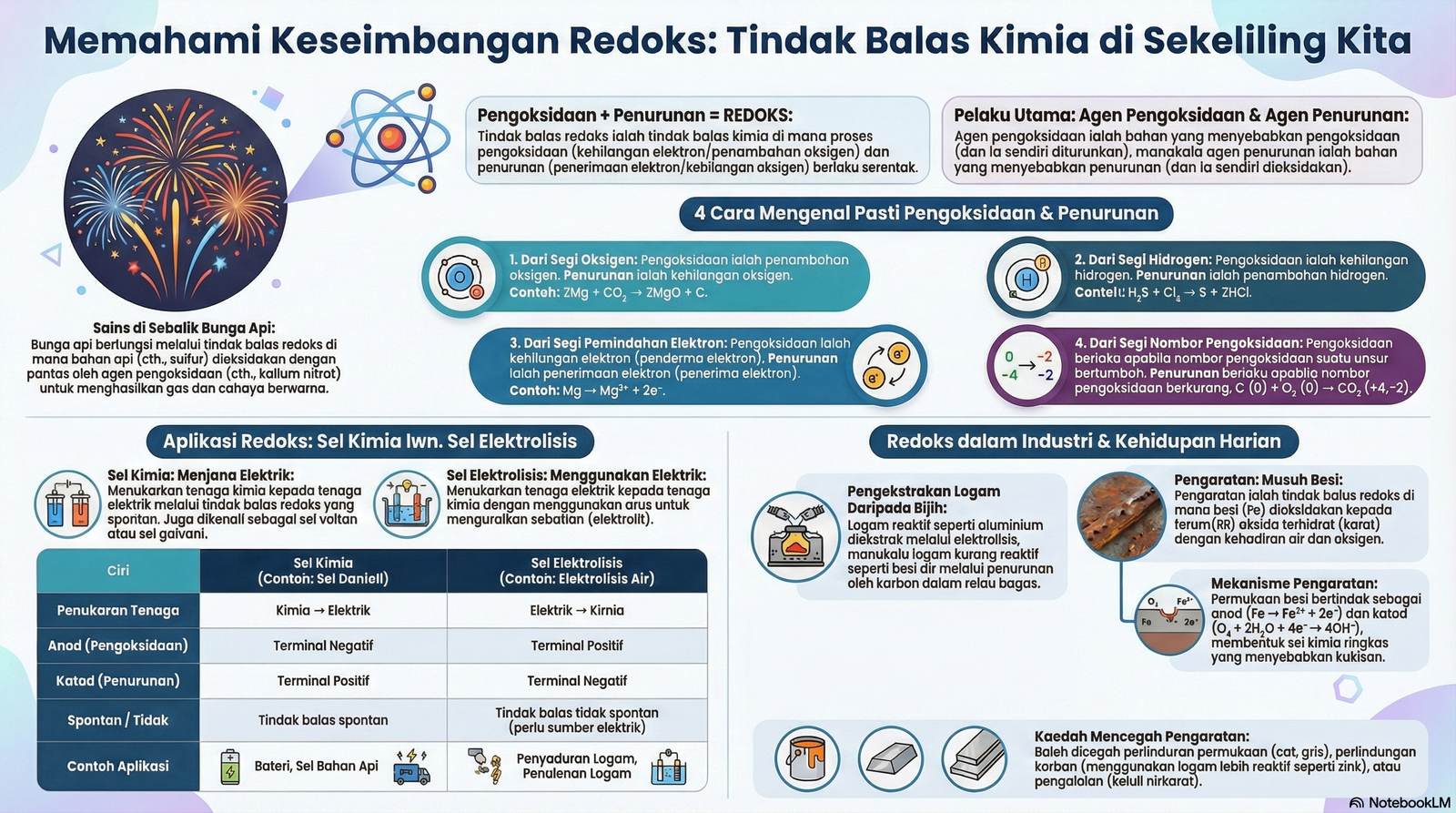
Bab ini meneroka konsep Keseimbangan Redoks, iaitu tindak balas kimia di mana proses pengoksidaan dan penurunan berlaku secara serentak. Tindak balas ini adalah asas kepada pelbagai fenomena semula jadi dan aplikasi industri, daripada pembakaran bunga api dan tujahan roket kepada penjanaan elektrik dalam sel kimia, pengekstrakan logam, dan proses pengaratan.
1. Definisi Pengoksidaan dan Penurunan
Tindak balas redoks boleh ditakrifkan melalui empat perspektif utama:
1. Dari Segi Oksigen:
◦ Pengoksidaan: Penambahan oksigen kepada suatu bahan. (Contoh: Magnesium bertindak balas dengan karbon dioksida membentuk magnesium oksida).
◦ Penurunan: Kehilangan oksigen daripada suatu bahan. (Contoh: Karbon dioksida kehilangan oksigen untuk membentuk karbon).
2. Dari Segi Hidrogen:
◦ Pengoksidaan: Kehilangan hidrogen daripada suatu bahan. (Contoh: Hidrogen sulfida kehilangan hidrogen apabila bertindak balas dengan klorin).
◦ Penurunan: Penambahan hidrogen kepada suatu bahan. (Contoh: Klorin menerima hidrogen untuk membentuk hidrogen klorida).
3. Dari Segi Pemindahan Elektron:
◦ Pengoksidaan: Kehilangan elektron oleh suatu bahan. Bahan yang kehilangan elektron bertindak sebagai agen penurunan. (Contoh: Atom magnesium, Mg, kehilangan elektron untuk menjadi ion Mg²⁺).
◦ Penurunan: Penerimaan elektron oleh suatu bahan. Bahan yang menerima elektron bertindak sebagai agen pengoksidaan. (Contoh: Molekul oksigen, O₂, menerima elektron).
4. Dari Segi Perubahan Nombor Pengoksidaan:
◦ Pengoksidaan: Pertambahan nombor pengoksidaan suatu unsur.
◦ Penurunan: Pengurangan nombor pengoksidaan suatu unsur.
◦ Ini adalah takrifan paling meluas yang merangkumi semua jenis tindak balas redoks, termasuk yang melibatkan sebatian kovalen.
2. Entiti Utama dalam Tindak Balas Redoks
• Agen Pengoksidaan: Bahan yang mengoksidakan bahan lain dan ia sendiri diturunkan dalam proses tersebut. Ia menerima elektron. Contohnya termasuk Kalium manganat(VII) berasid (KMnO₄) dan air klorin (Cl₂).
• Agen Penurunan: Bahan yang menurunkan bahan lain dan ia sendiri dioksidakan dalam proses tersebut. Ia menderma elektron. Contohnya termasuk logam reaktif (seperti Zink, Zn) dan Ferum(II) sulfat (FeSO₄).
3. Aplikasi dan Konsep Utama
• Keupayaan Elektrod Piawai (E⁰): Ukuran kecenderungan suatu bahan untuk menerima atau membebaskan elektron pada keadaan piawai. Nilai E⁰ digunakan untuk:
◦ Menentukan kekuatan agen pengoksidaan dan agen penurunan.
◦ Meramalkan sama ada suatu tindak balas redoks boleh berlaku.
◦ Mengira voltan sel kimia.
◦ Bahan dengan nilai E⁰ lebih positif ialah agen pengoksidaan yang lebih kuat, manakala bahan dengan nilai E⁰ lebih negatif ialah agen penurunan yang lebih kuat.
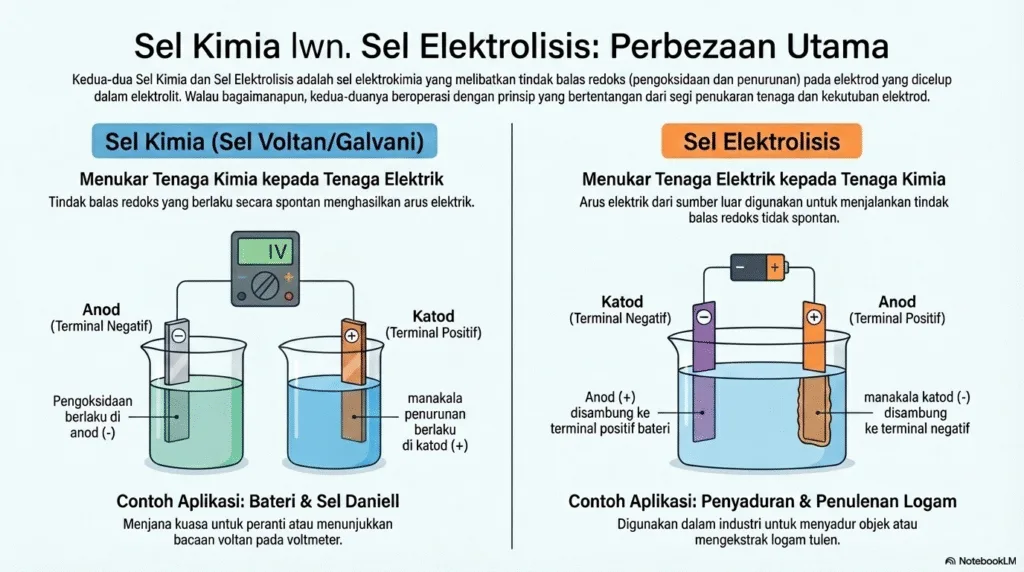
• Sel Kimia (Sel Voltan/Galvani): Peranti yang menukarkan tenaga kimia kepada tenaga elektrik melalui tindak balas redoks spontan.
◦ Anod (Terminal Negatif): Tempat berlakunya pengoksidaan.
◦ Katod (Terminal Positif): Tempat berlakunya penurunan.
◦ Elektron mengalir dari anod ke katod melalui litar luar.
◦ Contoh klasik ialah Sel Daniell, yang menggunakan elektrod zink dan kuprum.
• Sel Elektrolisis: Proses penguraian sebatian (elektrolit) dalam keadaan lebur atau larutan akueus kepada unsur juzuknya menggunakan tenaga elektrik.
◦ Anod (Terminal Positif): Tempat berlakunya pengoksidaan (anion bergerak ke sini).
◦ Katod (Terminal Negatif): Tempat berlakunya penurunan (kation bergerak ke sini).
◦ Aplikasi termasuk penyaduran logam, penulenan logam, dan pengekstrakan logam reaktif seperti aluminium.
• Pengekstrakan Logam:
◦ Elektrolisis: Digunakan untuk logam yang sangat reaktif (contoh: aluminium daripada bauksit).
◦ Penurunan oleh Karbon: Digunakan untuk logam yang kurang reaktif daripada karbon (contoh: besi daripada hematit dalam relau bagas).
• Pengaratan: Satu contoh kakisan logam yang merupakan tindak balas redoks. Besi (Fe) dioksidakan kepada ion ferum(II), Fe²⁺ (di anod) manakala oksigen (O₂) diturunkan dengan kehadiran air untuk membentuk ion hidroksida, OH⁻ (di katod). Kehadiran elektrolit seperti garam atau asid mempercepatkan proses ini.
GLOSARI
| Istilah | Definisi |
| Agen Pengoksidaan | Bahan yang menyebabkan pengoksidaan berlaku pada bahan lain, manakala ia sendiri mengalami penurunan (menerima elektron). |
| Agen Penurunan | Bahan yang menyebabkan penurunan berlaku pada bahan lain, manakala ia sendiri mengalami pengoksidaan (menderma elektron). |
| Anod | Elektrod di mana tindak balas pengoksidaan berlaku. Dalam sel kimia, ia adalah terminal negatif. Dalam sel elektrolisis, ia adalah elektrod yang disambungkan ke terminal positif bateri. |
| Elektrolisis | Proses penguraian suatu sebatian (elektrolit) dalam keadaan lebur atau larutan akueus kepada unsur juzuknya apabila arus elektrik dialirkan melaluinya. |
| Elektrolit | Bahan yang dapat mengalirkan arus elektrik dalam keadaan lebur atau larutan akueus dan mengalami perubahan kimia. Kekonduksiannya disebabkan oleh ion-ion yang bebas bergerak. |
| Katod | Elektrod di mana tindak balas penurunan berlaku. Dalam sel kimia, ia adalah terminal positif. Dalam sel elektrolisis, ia adalah elektrod yang disambungkan ke terminal negatif bateri. |
| Keadaan Pengoksidaan | Juga dikenali sebagai nombor pengoksidaan. Ia merujuk kepada cas yang dimiliki oleh suatu unsur dalam sebatian jika pemindahan elektron dianggap berlaku sepenuhnya. |
| Keupayaan Elektrod Piawai (E⁰) | Beza keupayaan yang terhasil apabila wujud keseimbangan antara elektrod dan larutan ionnya pada keadaan piawai (kepekatan 1.0 mol dm⁻³, suhu 25 °C, tekanan 1 atm). |
| Pengaratan | Proses kakisan logam yang berlaku khusus pada besi, iaitu tindak balas redoks antara besi, oksigen, dan air untuk membentuk ferum(III) oksida terhidrat (Fe₂O₃.xH₂O). |
| Pengoksidaan | Proses yang melibatkan: penambahan oksigen, kehilangan hidrogen, kehilangan elektron, atau pertambahan nombor pengoksidaan. |
| Penurunan | Proses yang melibatkan: kehilangan oksigen, penambahan hidrogen, penerimaan elektron, atau pengurangan nombor pengoksidaan. |
| Sel Kimia | Juga dikenali sebagai sel voltan atau sel galvani. Peranti yang menukarkan tenaga kimia kepada tenaga elektrik melalui tindak balas redoks. |
| Sel Elektrolisis | Peranti yang menggunakan tenaga elektrik untuk menjalankan tindak balas redoks yang tidak spontan, menyebabkan penguraian elektrolit. |
| Siri Elektrokimia | Satu siri penyusunan logam mengikut tertib keupayaan elektrod piawai (E⁰), dari yang paling negatif kepada yang paling positif. |
| Tindak Balas Penyesaran | Tindak balas di mana logam yang lebih elektropositif (agen penurunan lebih kuat) menyesarkan logam yang kurang elektropositif daripada larutan garamnya. Begitu juga, halogen yang lebih reaktif (agen pengoksidaan lebih kuat) menyesarkan halogen yang kurang reaktif daripada larutan halidanya. |
| Tindak Balas Redoks | Tindak balas kimia di mana pengoksidaan dan penurunan berlaku secara serentak. |
Koleksi Latihan
| 1 | 2 |
| 3 | 4 |
| 5 | 6 |
CONTOH SOALAN KBAT
Soalan Kemahiran Berfikir Aras Tinggi (KBAT)
Soalan 1: Sebuah tin makanan diperbuat daripada keluli (besi) yang disadur dengan lapisan nipis timah (stanum, Sn). Ali secara tidak sengaja menyebabkan tin tersebut kemik dan lapisan timah tercalar, mendedahkan keluli di bawahnya. Menggunakan pengetahuan tentang siri keupayaan elektrod piawai dan mekanisme pengaratan, ramalkan dan terangkan mengapa proses pengaratan pada bahagian yang tercalar itu berlaku dengan sangat cepat.
Jawapan: Berdasarkan prinsip elektrokimia, apabila dua logam berlainan bersentuhan dengan kehadiran elektrolit (kelembapan dari udara atau makanan), satu sel kimia ringkas terbentuk.
1. Perbandingan Keelektropositifan: Besi (Fe) adalah lebih elektropositif daripada timah (Sn). Ini bermakna atom ferum, Fe, lebih cenderung untuk melepaskan elektron berbanding atom stanum, Sn.
2. Pembentukan Anod dan Katod: Dalam sel yang terbentuk pada bahagian calar, besi yang lebih elektropositif akan bertindak sebagai terminal negatif (anod), manakala timah yang kurang elektropositif bertindak sebagai terminal positif (katod).
3. Proses Pengoksidaan (Pengaratan): Oleh kerana besi bertindak sebagai anod, ia akan dioksidakan atau terkakis dengan lebih cepat. Atom ferum, Fe, akan kehilangan elektron untuk membentuk ion ferum(II), Fe²⁺.
◦ Setengah Persamaan Pengoksidaan: Fe(p) → Fe²⁺(ak) + 2e⁻
4. Proses Penurunan: Elektron yang dibebaskan oleh besi akan mengalir ke permukaan timah (katod), di mana oksigen dan air akan diturunkan untuk membentuk ion hidroksida, OH⁻.
◦ Setengah Persamaan Penurunan: O₂(g) + 2H₂O(ce) + 4e⁻ → 4OH⁻(ak)
5. Kesimpulan: Timah mempercepatkan pengaratan besi apabila lapisan pelindungnya tercalar kerana ia mewujudkan sel elektrokimia di mana besi menjadi anod korban dan terkakis dengan kadar yang lebih pantas.
——————————————————————————–
Soalan 2: Dalam proses pengekstrakan aluminium daripada bauksit (aluminium oksida, Al₂O₃), kriolit (Na₃AlF₆) dicampurkan ke dalam leburan sebelum proses elektrolisis dijalankan. Selain daripada itu, anod yang diperbuat daripada karbon perlu diganti secara berkala. Terangkan mengapa kedua-dua langkah ini penting dalam proses industri tersebut.
Jawapan:
1. Peranan Kriolit (Na₃AlF₆): Aluminium oksida (Al₂O₃) mempunyai takat lebur yang sangat tinggi, iaitu sekitar 2000 °C. Meleburkan Al₂O₃ pada suhu ini memerlukan kos tenaga yang amat tinggi dan tidak ekonomik. Kriolit ditambah untuk merendahkan takat lebur campuran kepada suhu yang lebih rendah. Ini secara signifikan mengurangkan penggunaan tenaga elektrik, menjadikan proses pengekstrakan lebih cekap dari segi kos.
2. Penggantian Anod Karbon: Semasa elektrolisis leburan Al₂O₃, ion oksida, O²⁻, bergerak ke anod karbon. Pada suhu yang tinggi di dalam sel, oksigen yang terhasil daripada tindak balas pengoksidaan (2O²⁻ → O₂ + 4e⁻) akan bertindak balas dengan anod karbon itu sendiri. Tindak balas ini menghasilkan gas karbon dioksida (C(p) + O₂(g) → CO₂(g)). Akibatnya, anod karbon akan terhakis dan habis digunakan dari semasa ke semasa. Oleh itu, ia perlu diganti secara berkala untuk memastikan proses elektrolisis dapat berjalan secara berterusan.
——————————————————————————–
Soalan 3: Satu sel kimia dibina menggunakan elektrod magnesium (Mg) dalam larutan magnesium nitrat 1.0 mol dm⁻³ dan elektrod kuprum (Cu) dalam larutan kuprum(II) nitrat 1.0 mol dm⁻³. Berdasarkan Jadual Keupayaan Elektrod Piawai (E⁰) yang dibekalkan, tentukan: a) Anod dan katod sel tersebut. b) Arah pengaliran elektron. c) Tuliskan notasi sel. d) Hitungkan voltan sel (E⁰ sel).
Jawapan: Nilai E⁰ daripada jadual:
• Mg²⁺(ak) + 2e⁻ ⇌ Mg(p) ; E⁰ = -2.38 V
• Cu²⁺(ak) + 2e⁻ ⇌ Cu(p) ; E⁰ = +0.34 V
a) Anod dan Katod: Logam dengan nilai E⁰ yang lebih negatif (lebih elektropositif) akan bertindak sebagai anod (terminal negatif) dan mengalami pengoksidaan. Logam dengan nilai E⁰ yang lebih positif akan bertindak sebagai katod (terminal positif) dan mengalami penurunan.
• Anod (Terminal Negatif): Magnesium, Mg (kerana E⁰ = -2.38 V adalah lebih negatif).
• Katod (Terminal Positif): Kuprum, Cu (kerana E⁰ = +0.34 V adalah lebih positif).
b) Arah Pengaliran Elektron: Elektron sentiasa mengalir dari anod ke katod melalui litar luar (wayar penyambung). Oleh itu, elektron mengalir dari elektrod magnesium, Mg, ke elektrod kuprum, Cu.
c) Notasi Sel: Anod ditulis di sebelah kiri dan katod di sebelah kanan, dipisahkan oleh titian garam (‖).
• Mg(p) | Mg²⁺(ak, 1.0 mol dm⁻³) ‖ Cu²⁺(ak, 1.0 mol dm⁻³) | Cu(p)
d) Voltan Sel (E⁰ sel): E⁰ sel = E⁰(katod) – E⁰(anod) E⁰ sel = (+0.34) – (-2.38) E⁰ sel = +2.72 V
——————————————————————————–
Soalan 4: Bunga api mengandungi campuran serbuk kalium nitrat (75%), arang (15%), dan sulfur (10%). Apabila dibakar, tindak balas redoks yang pantas berlaku menghasilkan cahaya dan bunyi. Kenal pasti bahan yang bertindak sebagai agen pengoksidaan dan agen penurunan. Jelaskan peranan setiap satu dalam tindak balas tersebut dari segi pengoksidaan dan penurunan.
Jawapan:
1. Agen Pengoksidaan: Kalium nitrat (KNO₃) adalah agen pengoksidaan. Ia merupakan sebatian yang kaya dengan oksigen. Peranannya adalah untuk membekalkan oksigen bagi pembakaran bahan api yang pantas. Dalam tindak balas ini, kalium nitrat akan mengalami penurunan.
2. Agen Penurunan (Bahan Api): Arang (karbon, C) dan sulfur (S) adalah agen penurunan atau bahan api. Peranan mereka adalah untuk terbakar dengan cepat dengan kehadiran oksigen yang dibekalkan oleh agen pengoksidaan. Semasa pembakaran, karbon dan sulfur akan mengalami pengoksidaan.
◦ Karbon dioksidakan untuk membentuk gas karbon monoksida dan gas karbon dioksida.
◦ Sulfur dioksidakan untuk membentuk gas sulfur dioksida.
3. Kesimpulan: Tindak balas redoks dalam bunga api berlaku apabila bahan api (arang dan sulfur) dioksidakan dengan pantas, manakala agen pengoksidaan (kalium nitrat) diturunkan secara serentak, membebaskan sejumlah besar tenaga dalam bentuk haba, cahaya, dan gas.
——————————————————————————–
Soalan 5: Seorang pelajar menjalankan dua set eksperimen elektrolisis larutan kuprum(II) sulfat, CuSO₄ 0.5 mol dm⁻³.
• Set I: Menggunakan elektrod karbon (lengai).
• Set II: Menggunakan elektrod kuprum (aktif). Bandingkan pemerhatian di anod bagi kedua-dua set dan terangkan perbezaan tersebut berdasarkan faktor-faktor yang mempengaruhi pemilihan ion untuk dinyahcas.
Jawapan: Set I (Elektrod Karbon – Lengai):
• Pemerhatian di Anod: Gelembung gas tidak berwarna terbebas.
• Penerangan: Dalam larutan akueus CuSO₄, terdapat ion sulfat (SO₄²⁻) dan ion hidroksida (OH⁻) yang akan bergerak ke anod lengai. Berdasarkan nilai E⁰, ion OH⁻ mempunyai nilai E⁰ yang kurang positif berbanding ion SO₄²⁻, jadi ion OH⁻ dipilih untuk dinyahcas dan dioksidakan.
◦ Setengah Persamaan di Anod: 4OH⁻(ak) → O₂(g) + 2H₂O(ce) + 4e⁻
◦ Gas yang terhasil ialah gas oksigen.
Set II (Elektrod Kuprum – Aktif):
• Pemerhatian di Anod: Elektrod kuprum di anod menjadi semakin nipis.
• Penerangan: Apabila elektrod aktif (kuprum) digunakan sebagai anod, faktor jenis elektrod mengatasi faktor nilai E⁰. Anion (SO₄²⁻ dan OH⁻) tidak akan dinyahcas. Sebaliknya, atom logam kuprum daripada elektrod itu sendiri lebih mudah dioksidakan. Atom kuprum, Cu, akan melepaskan elektron dan mengion untuk membentuk ion kuprum(II), Cu²⁺, yang larut ke dalam elektrolit.
◦ Setengah Persamaan di Anod: Cu(p) → Cu²⁺(ak) + 2e⁻
Perbandingan dan Kesimpulan: Perbezaan pemerhatian berlaku kerana faktor yang menentukan tindak balas di anod adalah berbeza. Dalam Set I, nilai E⁰ anion menentukan hasil (gas oksigen). Dalam Set II, jenis elektrod (aktif) yang digunakan menentukan hasil, di mana elektrod itu sendiri dioksidakan (melarut).
