Nota Kimia Tingkatan 5 Bab 2: Sebatian Karbon

RINGKASAN
Ringkasan Konsep Utama (Nota Kimia Tingkatan 5 Bab 2: Sebatian Karbon)
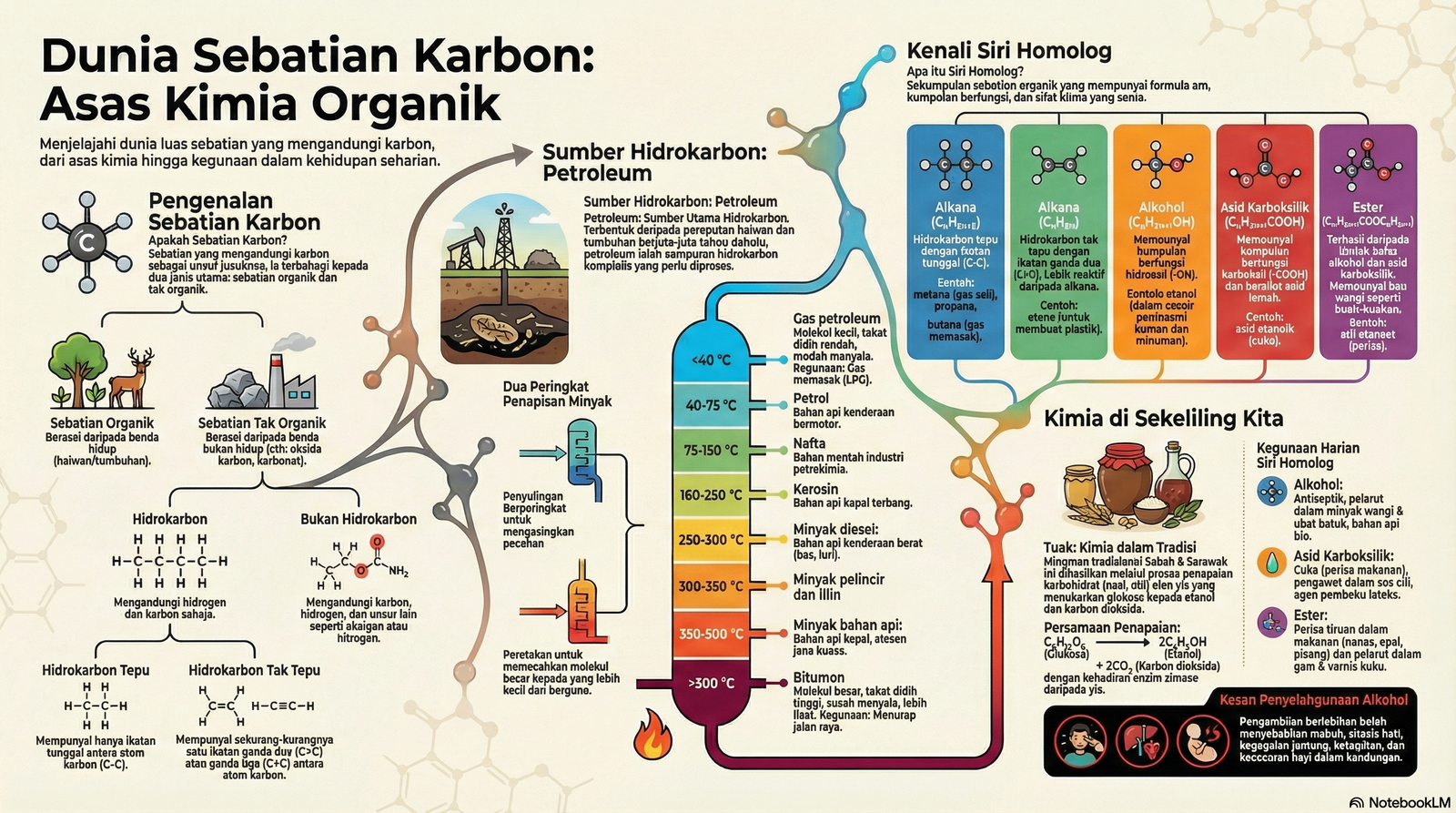
Sebatian karbon adalah sebatian yang mengandungi karbon sebagai unsur juzuknya dan dibahagikan kepada dua jenis utama: sebatian organik dan sebatian tak organik.
• Sebatian Organik: Berasal daripada benda hidup dan mengandungi unsur karbon yang terikat secara kovalen dengan unsur lain. Ia terbahagi kepada hidrokarbon dan bukan hidrokarbon.
◦ Hidrokarbon: Sebatian yang mengandungi hidrogen dan karbon sahaja. Sumber utamanya ialah petroleum (minyak mentah).
▪ Hidrokarbon Tepu: Mempunyai hanya ikatan tunggal antara atom karbon (contoh: Alkana).
▪ Hidrokarbon Tak Tepu: Mempunyai sekurang-kurangnya satu ikatan ganda dua atau ganda tiga antara atom karbon (contoh: Alkena, Alkuna).
◦ Bukan Hidrokarbon: Sebatian organik yang mengandungi karbon, hidrogen, serta unsur lain seperti oksigen dan nitrogen (contoh: Alkohol, Asid Karboksilik, Ester).
• Sebatian Tak Organik: Berasal daripada benda bukan hidup seperti oksida karbon dan sebatian karbonat.
Pemprosesan Petroleum: Petroleum, campuran hidrokarbon, diproses melalui dua peringkat utama:
1. Penyulingan Berperingkat: Mengasingkan pecahan hidrokarbon berdasarkan takat didih yang berbeza. Hidrokarbon dengan takat didih rendah meruap dahulu dan naik ke bahagian atas menara pemeringkat.
2. Peretakan: Proses memecahkan hidrokarbon rantai panjang kepada molekul yang lebih kecil (seperti petrol dan alkena) pada suhu dan tekanan tinggi dengan kehadiran mangkin.
Siri Homolog: Kumpulan sebatian organik yang mempunyai ciri-ciri berikut:
• Formula am yang sama.
• Kumpulan berfungsi yang sama.
• Sifat kimia yang sama.
• Ahli berturutan berbeza sebanyak satu atom karbon dan dua atom hidrogen (CH₂).
• Sifat fizik berubah secara beransur-ansur.
| Siri Homolog | Formula Am | Kumpulan Berfungsi | Jenis Sebatian |
| Alkana | CₙH₂ₙ₊₂, n = 1, 2, 3, … | Ikatan tunggal C-C | Hidrokarbon Tepu |
| Alkena | CₙH₂ₙ, n = 2, 3, 4, … | Ikatan ganda dua C=C | Hidrokarbon Tak Tepu |
| Alkuna | CₙH₂ₙ₋₂, n = 2, 3, 4, … | Ikatan ganda tiga C≡C | Hidrokarbon Tak Tepu |
| Alkohol | CₙH₂ₙ₊₁OH, n = 1, 2, 3, … | Hidroksil (-OH) | Bukan Hidrokarbon |
| Asid Karboksilik | CₙH₂ₙ₊₁COOH, n = 0, 1, 2, … | Karboksil (-COOH) | Bukan Hidrokarbon |
| Ester | CₘH₂ₘ₊₁COOCₙH₂ₙ₊₁, m≥0, n≥1 | Karboksilat (-COO-) | Bukan Hidrokarbon |
Sifat Kimia Utama:
• Alkana: Mengalami pembakaran (lengkap dan tidak lengkap) dan tindak balas penukargantian dengan halogen di bawah sinaran UV.
• Alkena: Lebih reaktif daripada alkana. Mengalami pembakaran, tindak balas penambahan (penghidrogenan, penghalogenan, penghidratan), pengoksidaan, dan pempolimeran penambahan.
• Alkohol: Mengalami pembakaran, pengoksidaan (menghasilkan asid karboksilik), dan pendehidratan (menghasilkan alkena).
• Asid Karboksilik: Menunjukkan sifat asid (bertindak balas dengan bes, logam karbonat, dan logam) dan bertindak balas dengan alkohol untuk menghasilkan ester (pengesteran).
• Ester: Terhasil melalui tindak balas pengesteran antara asid karboksilik dan alkohol.
Keisomeran dan Penamaan:
• Isomer: Molekul yang mempunyai formula molekul yang sama tetapi formula struktur yang berbeza.
• Keisomeran Struktur: Fenomena di mana isomer wujud disebabkan oleh susunan rantai karbon yang berbeza (isomer rantai) atau kedudukan kumpulan berfungsi yang berbeza (isomer kedudukan).
• Penamaan IUPAC: Sistem penamaan sebatian organik yang sistematik berdasarkan rantai karbon terpanjang, kumpulan cabang (alkil), dan kumpulan berfungsi.
GLOSARI
| Istilah | Definisi |
| Alkana | Siri homolog hidrokarbon tepu dengan formula am CₙH₂ₙ₊₂. |
| Alkena | Siri homolog hidrokarbon tak tepu dengan ikatan ganda dua dan formula am CₙH₂ₙ. |
| Alkohol | Siri homolog bukan hidrokarbon dengan kumpulan berfungsi hidroksil (-OH) dan formula am CₙH₂ₙ₊₁OH. |
| Alkuna | Siri homolog hidrokarbon tak tepu dengan ikatan ganda tiga dan formula am CₙH₂ₙ₋₂. |
| Asid Karboksilik | Siri homolog bukan hidrokarbon dengan kumpulan berfungsi karboksil (-COOH) dan formula am CₙH₂ₙ₊₁COOH. |
| Bukan Hidrokarbon | Sebatian organik yang mengandungi karbon dan hidrogen serta unsur lain seperti oksigen, nitrogen, atau halogen. |
| Ester | Siri homolog bukan hidrokarbon dengan kumpulan berfungsi karboksilat (-COO-), terhasil daripada tindak balas antara asid karboksilik dan alkohol. |
| Hidrokarbon | Sebatian organik yang mengandungi unsur karbon dan hidrogen sahaja. |
| Hidrokarbon Tak Tepu | Hidrokarbon yang mempunyai sekurang-kurangnya satu ikatan ganda dua atau ganda tiga antara atom karbon. |
| Hidrokarbon Tepu | Hidrokarbon yang mempunyai hanya ikatan tunggal antara atom karbon. |
| Isomer | Molekul-molekul yang mempunyai formula molekul yang sama tetapi formula struktur yang berbeza. |
| Keisomeran Struktur | Fenomena di mana suatu sebatian mempunyai formula molekul yang sama tetapi dua atau lebih formula struktur yang berbeza. |
| Kumpulan Berfungsi | Kumpulan atom yang terikat kepada sebatian molekul organik yang menentukan sifat kimia suatu siri homolog. |
| Penapaian | Proses penguraian molekul besar seperti glukosa kepada molekul kecil seperti etanol oleh yis (atau enzim zimase) dalam keadaan tanpa oksigen. |
| Pendehidratan | Tindak balas penyingkiran molekul air daripada setiap molekul alkohol untuk menghasilkan alkena yang sepadan. |
| Pengesteran | Tindak balas antara asid karboksilik dengan alkohol untuk menghasilkan ester dan air, dengan kehadiran asid sulfurik pekat sebagai mangkin. |
| Penyulingan Berperingkat | Proses mengasingkan pecahan dalam petroleum berdasarkan perbezaan takat didih setiap pecahan hidrokarbon. |
| Peretakan | Proses di mana hidrokarbon rantai panjang dipecahkan kepada hidrokarbon yang lebih kecil pada suhu dan tekanan tinggi dengan kehadiran mangkin. |
| Sebatian Karbon | Sebatian yang mengandungi karbon sebagai unsur juzuknya. |
| Sebatian Organik | Sebatian yang berasal daripada benda hidup dan mengandungi unsur karbon yang terikat secara kovalen. |
| Siri Homolog | Satu siri sebatian organik yang mempunyai formula am dan kumpulan berfungsi yang sama, serta sifat kimia yang serupa. |
| Tindak Balas Penambahan | Tindak balas di mana atom lain ditambah pada setiap atom karbon pada ikatan ganda dua atau ganda tiga untuk membentuk hasil dengan ikatan tunggal. |
| Tindak Balas Penukargantian | Tindak balas di mana setiap atom hidrogen dalam molekul alkana digantikan satu demi satu oleh atom-atom halogen. |
| Tuak | Minuman yang disediakan melalui proses penapaian makanan seperti ubi kayu, nasi atau beras pulut dengan yis. |
| Zimase | Enzim yang dirembeskan oleh yis yang menukarkan glukosa kepada etanol dan karbon dioksida. |
Koleksi Latihan
| 1 | 2 |
| 3 | 4 |
| 5 | 6 |
CONTOH SOALAN KBAT
Soalan dan Jawapan Kemahiran Berfikir Aras Tinggi (KBAT)
Soalan 1: Proses penyulingan berperingkat petroleum tidak dapat memenuhi permintaan pasaran yang tinggi untuk petrol. Terangkan bagaimana proses peretakan (cracking) dapat menyelesaikan masalah ini dan jelaskan kepentingan ekonominya kepada industri petrokimia.
Jawapan: Menurut sumber, permintaan terhadap hidrokarbon bersaiz kecil seperti petrol adalah lebih tinggi kerana ia lebih mudah terbakar dan digunakan secara meluas sebagai bahan api. Walau bagaimanapun, proses penyulingan berperingkat tidak menghasilkan hidrokarbon bersaiz kecil dalam kuantiti yang mencukupi untuk memenuhi permintaan ini.
Proses peretakan menyelesaikan masalah ini dengan memecahkan molekul hidrokarbon rantai panjang (yang kurang permintaan) kepada molekul hidrokarbon yang lebih kecil dan lebih berguna. Proses ini dijalankan pada suhu dan tekanan tinggi dengan kehadiran mangkin seperti aluminium oksida (Al₂O₃) dan silikon(IV) oksida (SiO₂). Hasil daripada peretakan termasuklah:
1. Hidrokarbon yang lebih kecil seperti petrol, yang secara langsung memenuhi permintaan tinggi sebagai bahan api.
2. Hidrokarbon alkena rantai pendek, yang berfungsi sebagai bahan mentah penting dalam industri petrokimia untuk penghasilan polimer, ubat, detergen, dan pelarut.
Kepentingan ekonominya adalah sangat besar kerana ia membolehkan syarikat penapisan minyak menukar pecahan petroleum bernilai rendah (hidrokarbon rantai panjang) kepada produk bernilai tinggi (petrol dan alkena), sekaligus memaksimumkan keuntungan dan kecekapan penggunaan sumber petroleum mentah.
——————————————————————————–
Soalan 2: Tuak, minuman tradisional etnik Sabah dan Sarawak, dihasilkan melalui proses penapaian. Pada masa yang sama, saintis sedang giat membangunkan bioetanol sebagai sumber tenaga alternatif. Hubungkaitkan proses kimia dalam penghasilan tuak dengan penghasilan bioetanol dan bincangkan mengapa bioetanol dianggap sebagai sumber tenaga yang boleh diperbaharui.
Jawapan: Proses kimia yang terlibat dalam kedua-dua penghasilan tuak dan bioetanol adalah penapaian. Sumber menyatakan bahawa tuak dihasilkan melalui penapaian makanan berkarbohidrat seperti ubi kayu atau beras pulut. Penapaian ditakrifkan sebagai penguraian molekul besar seperti glukosa (C₆H₁₂O₆) kepada molekul kecil seperti etanol (C₂H₅OH) dan karbon dioksida (CO₂) dengan bantuan yis yang merembeskan enzim zimase. Persamaan kimianya ialah: C₆H₁₂O₆(ak) → 2C₂H₅OH(ce) + 2CO₂(g)
Penghasilan bioetanol sebagai sumber tenaga alternatif juga menggunakan proses yang sama. Ia dihasilkan melalui proses kimia yang bersumberkan biojisim, iaitu bahan organik daripada tumbuhan dan haiwan. Sama seperti bahan untuk tuak, biojisim (contohnya sisa makanan atau tanaman seperti tebu) kaya dengan karbohidrat yang boleh ditukarkan kepada glukosa dan kemudian ditapai untuk menghasilkan etanol. Etanol ini kemudiannya boleh digunakan sebagai bahan api.
Bioetanol dianggap sebagai sumber tenaga yang boleh diperbaharui kerana ia berasal daripada biojisim. Biojisim seperti tumbuhan boleh ditanam semula secara berterusan, berbeza dengan bahan api fosil seperti petroleum yang mengambil masa berjuta-juta tahun untuk terbentuk dan merupakan sumber yang tidak dapat diperbaharui.
——————————————————————————–
Soalan 3: Heksana (C₆H₁₄) dan heksena (C₆H₁₂) kedua-duanya adalah sebatian hidrokarbon cecair tanpa warna. Berdasarkan maklumat dalam teks, rancang satu siri ujian makmal ringkas untuk membezakan kedua-dua sebatian ini, dan ramalkan pemerhatian yang dijangkakan bagi setiap ujian.
Jawapan: Untuk membezakan heksana (alkana) dan heksena (alkena), kita boleh mengeksploitasi perbezaan kereaktifan kimia antara hidrokarbon tepu dan tak tepu. Heksena lebih reaktif kerana kehadiran ikatan ganda dua antara atom karbonnya. Dua ujian makmal yang sesuai adalah seperti berikut:
Ujian 1: Tindak Balas dengan Air Bromin (Br₂)
• Prosedur: Masukkan 2 cm³ setiap sebatian (heksana dan heksena) ke dalam tabung uji berasingan. Tambahkan 2-3 titis air bromin (yang berwarna perang) ke dalam setiap tabung uji dan goncangkan campuran.
• Pemerhatian Diramalkan:
◦ Heksena (Alkena): Warna perang air bromin akan dinyahwarnakan (menjadi tanpa warna). Ini kerana heksena mengalami tindak balas penambahan (penghalogenan) di mana molekul bromin ditambah merentasi ikatan ganda duanya.
◦ Heksana (Alkana): Tiada perubahan akan berlaku. Warna perang air bromin akan kekal kerana heksana adalah hidrokarbon tepu dan tidak bertindak balas dengan bromin pada keadaan bilik tanpa kehadiran sinaran UV.
Ujian 2: Tindak Balas dengan Larutan Kalium Manganat(VII) Berasid (KMnO₄)
• Prosedur: Masukkan 2 cm³ setiap sebatian ke dalam tabung uji berasingan. Tambahkan 2-3 titis larutan kalium manganat(VII) berasid (yang berwarna ungu) ke dalam setiap tabung uji dan goncangkan.
• Pemerhatian Diramalkan:
◦ Heksena (Alkena): Warna ungu larutan kalium manganat(VII) berasid akan dinyahwarnakan. Ini kerana heksena dioksidakan oleh agen pengoksidaan kuat ini, di mana dua kumpulan hidroksil (-OH) ditambah pada ikatan ganda duanya.
◦ Heksana (Alkana): Tiada perubahan akan berlaku. Warna ungu larutan akan kekal kerana alkana tidak mudah dioksidakan.
——————————————————————————–
Soalan 4: Keisomeran struktur adalah fenomena di mana satu formula molekul boleh mewakili beberapa sebatian dengan formula struktur yang berbeza. Lukiskan dan namakan mengikut sistem penamaan IUPAC kesemua isomer struktur bagi butanol (C₄H₉OH). Terangkan bagaimana isomer-isomer ini menunjukkan kedua-dua jenis keisomeran: keisomeran rantai dan keisomeran kedudukan.
Jawapan: Butanol (C₄H₉OH) mempunyai empat isomer struktur.
1. Butan-1-ol
◦ Struktur: Rantai lurus dengan kumpulan -OH pada karbon pertama.
◦ Lukisan: CH₃-CH₂-CH₂-CH₂-OH
2. Butan-2-ol
◦ Struktur: Rantai lurus dengan kumpulan -OH pada karbon kedua.
◦ Lukisan: CH₃-CH₂-CH(OH)-CH₃
3. 2-metilpropan-1-ol
◦ Struktur: Rantai bercabang (rantai utama 3 karbon) dengan kumpulan -OH pada karbon pertama.
◦ Lukisan: (CH₃)₂CH-CH₂-OH
4. 2-metilpropan-2-ol
◦ Struktur: Rantai bercabang (rantai utama 3 karbon) dengan kumpulan -OH pada karbon kedua.
◦ Lukisan: (CH₃)₃C-OH
Penjelasan Jenis Keisomeran:
• Keisomeran Kedudukan: Isomer ini mempunyai susunan rantai karbon yang sama tetapi kedudukan kumpulan berfungsi (-OH) yang berbeza.
◦ Contoh: Butan-1-ol dan Butan-2-ol kedua-duanya mempunyai rantai karbon lurus dengan 4 atom karbon, tetapi kedudukan kumpulan -OH berbeza (pada karbon ke-1 vs karbon ke-2).
• Keisomeran Rantai: Isomer ini mempunyai susunan rantai karbon yang berbeza (rantai lurus vs rantai bercabang).
◦ Contoh: Butan-1-ol (rantai lurus 4 karbon) dan 2-metilpropan-1-ol (rantai utama 3 karbon dengan cabang metil) adalah isomer rantai. Kedua-duanya mempunyai kumpulan -OH pada karbon pertama tetapi struktur rangkanya berbeza.
Oleh itu, keempat-empat isomer butanol ini secara kolektif menunjukkan kedua-dua fenomena keisomeran rantai dan kedudukan.
——————————————————————————–
Soalan 5: Alkohol boleh ditukarkan kepada alkena melalui tindak balas pendehidratan, dan alkena boleh ditukarkan kembali kepada alkohol melalui tindak balas penghidratan. Dengan menggunakan etanol (C₂H₅OH) dan etena (C₂H₄) sebagai contoh, huraikan keadaan yang diperlukan untuk kedua-dua tindak balas saling pertukaran ini dan tuliskan persamaan kimia bagi setiap proses.
Jawapan: Saling pertukaran antara alkohol dan alkena adalah mungkin melalui tindak balas pendehidratan dan penghidratan.
1. Pendehidratan Etanol kepada Etena:
• Penerangan: Pendehidratan alkohol melibatkan penyingkiran satu molekul air (H₂O) daripada molekul alkohol untuk menghasilkan alkena yang sepadan.
• Keadaan Tindak Balas: Wap etanol (C₂H₅OH) perlu dilalukan ke atas mangkin yang dipanaskan dengan kuat. Mangkin yang digunakan boleh jadi serpihan porselin, aluminium oksida (alumina), atau asid sulfurik pekat.
• Persamaan Kimia: C₂H₅OH(g) –(Serpihan Porselin, Panas)–> C₂H₄(g) + H₂O(ce) (Etanol → Etena + Air)
2. Penghidratan Etena kepada Etanol:
• Penerangan: Penghidratan alkena melibatkan penambahan satu molekul air (dalam bentuk stim) kepada alkena untuk menghasilkan alkohol.
• Keadaan Tindak Balas: Tindak balas ini memerlukan suhu dan tekanan yang tinggi serta kehadiran mangkin. Secara spesifik, gas etena (C₂H₄) bertindak balas dengan stim (H₂O) pada suhu 300 °C, tekanan 60 atm, dan dimangkinkan oleh asid fosforik (H₃PO₄).
• Persamaan Kimia: C₂H₄(g) + H₂O(g) –(H₃PO₄, 300°C, 60 atm)–> C₂H₅OH(ce) (Etena + Stim → Etanol)
Kedua-dua proses ini menunjukkan bagaimana satu siri homolog boleh ditukarkan kepada yang lain dengan mengawal keadaan tindak balas, yang merupakan konsep penting dalam sintesis kimia organik.
