Nota Sains Tambahan Tingkatan 5 Bab 2: Garam
RINGKASAN
Ringkasan (Nota Sains Tambahan Tingkatan 5 Bab 2: Garam)
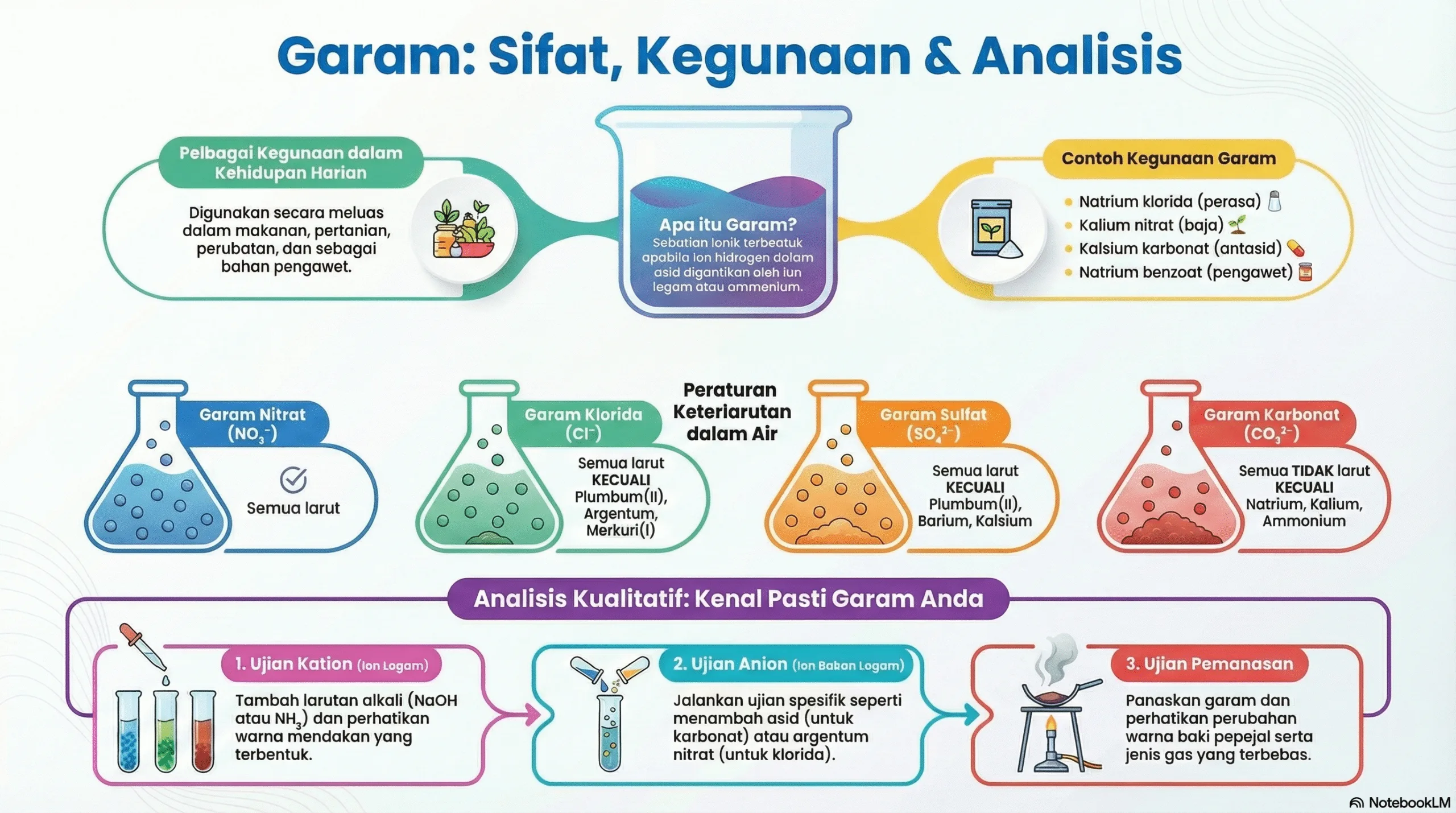
Bab ini memberi tumpuan kepada garam, sebatian ionik yang terbentuk apabila ion hidrogen dalam asid digantikan oleh ion logam atau ion ammonium. Ia merangkumi definisi, kegunaan, kaedah penyediaan, dan teknik analisis kualitatif untuk mengenal pasti komponennya.
1. Pengenalan dan Kegunaan Garam
• Definisi: Garam ialah sebatian ionik yang terhasil daripada tindak balas peneutralan antara asid dan bes. Ia terdiri daripada kation (daripada bes) dan anion (daripada asid).
• Contoh Pembentukan: HCl (asid) + NaOH (bes) → NaCl (garam) + H₂O (air).
• Kegunaan Harian:
◦ Penyediaan Makanan: Natrium klorida (NaCl) sebagai perasa, Monosodium glutamat (MSG) sebagai penambah rasa, Natrium bikarbonat (NaHCO₃) sebagai serbuk penaik.
◦ Pertanian: Garam nitrat (cth., kalium nitrat, KNO₃) dan garam ammonium (cth., ammonium nitrat, NH₄NO₃) digunakan sebagai baja bernitrogen.
◦ Pengawetan Makanan: Natrium benzoat (C₆H₅COONa) digunakan dalam sos dan jem.
◦ Perubatan: Kalsium karbonat (CaCO₃) dalam ubat antasid, dan Kalsium sulfat (CaSO₄) dalam Plaster of Paris untuk tulang patah.
◦ Lain-lain: Stanum(II) fluorida (SnF₂) dalam ubat gigi, Argentum bromida (AgBr) dalam filem fotografi.
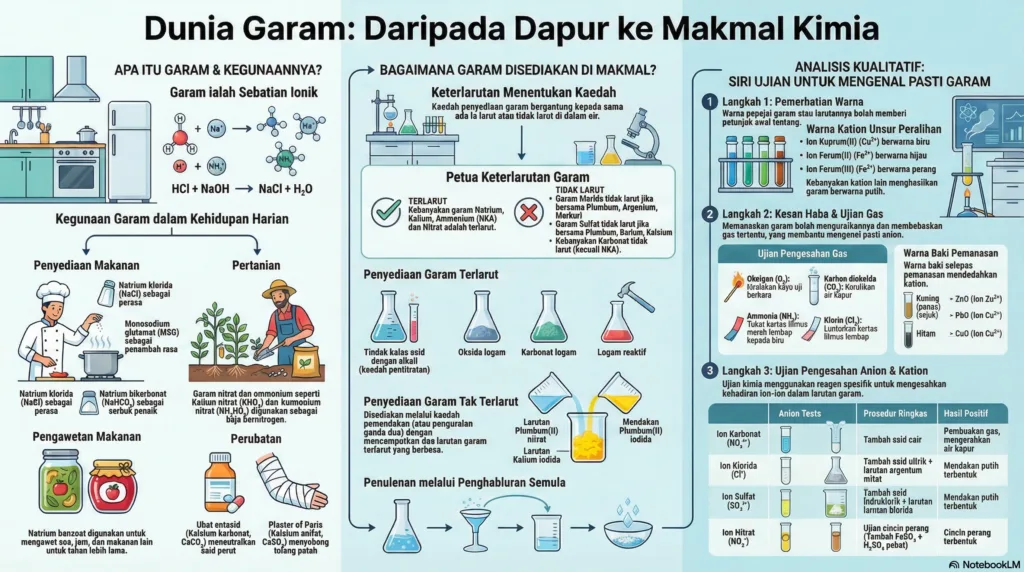
2. Penyediaan Garam
Garam dikelaskan kepada garam terlarut dan garam tak terlarut, dan kaedah penyediaannya berbeza.
Garam Terlarut
• Garam Natrium, Kalium, dan Ammonium: Disediakan melalui tindak balas peneutralan antara asid dan alkali menggunakan kaedah pentitratan.
• Garam Terlarut Lain: Disediakan melalui tindak balas asid dengan bahan berlebihan:
1. Asid + Logam Reaktif: cth., Asid hidroklorik + Ferum → Ferum(II) klorida
2. Asid + Oksida Logam: cth., Asid hidroklorik + Kuprum(II) oksida → Kuprum(II) klorida
3. Asid + Karbonat Logam: cth., Asid hidroklorik + Magnesium karbonat → Magnesium klorida
Garam Tak Terlarut
• Disediakan melalui kaedah pemendakan atau tindak balas penguraian ganda dua.
• Proses ini melibatkan pencampuran dua larutan garam terlarut yang berbeza untuk menghasilkan satu garam tak terlarut (mendakan) dan satu garam terlarut.
• Contoh: Larutan Plumbum(II) nitrat + Larutan Kalium iodida → Plumbum(II) iodida (mendakan kuning) + Larutan Kalium nitrat.
3. Analisis Kualitatif Garam
Analisis kualitatif ialah satu siri ujian kimia yang dijalankan untuk mengenal pasti kation (ion positif) dan anion (ion negatif) yang hadir dalam suatu sampel garam.
Langkah-langkah Analisis:
1. Pemerhatian Sifat Fizikal:
◦ Warna: Kebanyakan garam berwarna putih. Garam yang mengandungi ion daripada unsur peralihan mempunyai warna spesifik (cth., ion Kuprum(II), Cu²⁺, berwarna biru; ion Ferum(II), Fe²⁺, berwarna hijau; ion Ferum(III), Fe³⁺, berwarna perang).
◦ Keterlarutan dalam Air: Keterlarutan bergantung pada jenis anion dan kation (Rujuk Jadual 2.2 dalam buku teks).
2. Kesan Haba ke Atas Garam:
◦ Garam Karbonat: Kebanyakan terurai apabila dipanaskan untuk menghasilkan oksida logam dan gas karbon dioksida, kecuali garam karbonat bagi Kalium dan Natrium.
◦ Garam Nitrat: Semua terurai apabila dipanaskan. Hasilnya berbeza bergantung pada kereaktifan logam.
◦ Baki Pemanasan: Warna baki selepas pemanasan dapat memberi petunjuk tentang kation yang hadir (cth., ZnO berwarna kuning semasa panas dan putih semasa sejuk; PbO berwarna perang semasa panas dan kuning semasa sejuk; CuO berwarna hitam).
3. Ujian Mengenal Pasti Gas:
◦ Oksigen (O₂): Menyalakan kayu uji berbara.
◦ Hidrogen (H₂): Menghasilkan bunyi ‘pop’ dengan kayu uji bernyala.
◦ Karbon dioksida (CO₂): Mengeruhkan air kapur.
◦ Ammonia (NH₃): Bersifat alkali (menukar kertas litmus merah lembap kepada biru) dan berbau sengit.
◦ Klorin (Cl₂): Melunturkan kertas litmus lembap dan berwarna kuning kehijauan.
◦ Sulfur dioksida (SO₂): Melunturkan warna ungu larutan kalium manganat(VII) berasid.
4. Ujian Pengesahan Anion (dalam larutan akueus):
◦ Ion Karbonat (CO₃²⁻): Tambah asid cair, gas yang terbebas mengeruhkan air kapur.
◦ Ion Klorida (Cl⁻): Tambah asid nitrik cair diikuti larutan argentum nitrat. Mendakan putih terbentuk.
◦ Ion Sulfat (SO₄²⁻): Tambah asid hidroklorik cair diikuti larutan barium klorida. Mendakan putih terbentuk.
◦ Ion Nitrat (NO₃⁻): Ujian cincin perang. Tambah larutan ferum(II) sulfat dan asid sulfurik cair, kemudian titiskan asid sulfurik pekat dengan cermat. Cincin perang terbentuk.
5. Ujian Pengesahan Kation (dalam larutan akueus):
◦ Menggunakan larutan alkali seperti natrium hidroksida (NaOH) dan larutan ammonia akueus (NH₃).
◦ Pemerhatian sama ada mendakan terbentuk dan keterlarutan mendakan tersebut dalam alkali berlebihan digunakan untuk mengenal pasti kation seperti Mg²⁺, Ca²⁺, Al³⁺, Pb²⁺, Zn²⁺, Cu²⁺, Fe²⁺, dan Fe³⁺.
GLOSARI
| Istilah | Definisi |
| Analisis Kualitatif | Teknik untuk mengenal pasti kation dan anion yang hadir di dalam sesuatu garam dengan menganalisis sifat fizik dan sifat kimianya. |
| Anion | Ion yang bercas negatif, biasanya berasal daripada asid dalam pembentukan garam (cth., Cl⁻, SO₄²⁻, NO₃⁻). |
| Garam | Sebatian ionik yang terhasil apabila ion hidrogen (H⁺) dalam suatu asid digantikan oleh ion logam atau ion ammonium (NH₄⁺). |
| Garam Tak Terlarut | Garam yang tidak larut dalam air. Contohnya termasuk plumbum(II) sulfat, barium sulfat, dan argentum klorida. |
| Garam Terlarut | Garam yang boleh larut dalam air. Semua garam natrium, kalium, ammonium, dan nitrat adalah terlarut. |
| Hablur | Pepejal yang mempunyai bentuk geometri yang sekata, permukaan rata, sisi lurus, dan bucu yang tajam. |
| Kation | Ion yang bercas positif, biasanya berasal daripada bes (ion logam atau ammonium) dalam pembentukan garam (cth., Na⁺, Cu²⁺, NH₄⁺). |
| Keterlarutan | Kebolehan satu bahan (zat terlarut) untuk larut dalam pelarut (cth., air) untuk membentuk larutan. |
| Mendakan | Pepejal tak terlarut yang terbentuk dalam larutan hasil daripada tindak balas kimia. |
| Peneutralan | Tindak balas antara asid dan bes (atau alkali) untuk menghasilkan garam dan air. |
| Penguraian Ganda Dua | Tindak balas antara dua larutan sebatian ionik (garam) yang berbeza untuk menghasilkan dua sebatian baru, di mana salah satunya ialah mendakan (garam tak terlarut). Juga dikenali sebagai tindak balas pemendakan. |
| Penghabluran | Proses pembentukan hablur pepejal daripada larutan tepu apabila larutan itu disejukkan atau pelarutnya disejatkan. |
| Pentitratan | Teknik makmal kuantitatif yang digunakan untuk menentukan kepekatan suatu larutan dengan mereaksikan ia dengan larutan lain yang diketahui kepekatannya. Digunakan untuk menyediakan garam terlarut melalui peneutralan. |
| Stoikiometri | Kajian tentang hubungan kuantitatif (nisbah mol) antara bahan tindak balas dan hasil dalam sesuatu tindak balas kimia. |
CONTOH SOALAN KBAT
Soalan Kemahiran Berfikir Aras Tinggi (KBAT)
Soalan 1: Berdasarkan Rajah 5 yang menunjukkan mekanisme pembekuan darah dan maklumat mengenai kegunaan garam dalam bidang perubatan, bandingkan peranan pembekuan darah dengan penggunaan Plaster of Paris (kalsium sulfat, CaSO4) dalam merawat kecederaan fizikal.
Jawapan: Kedua-dua mekanisme pembekuan darah dan penggunaan Plaster of Paris adalah tindak balas terhadap kecederaan fizikal, tetapi fungsinya berbeza secara fundamental.
• Mekanisme Pembekuan Darah: Ia adalah proses biologi dalaman. Apabila luka berlaku, ia menghentikan pendarahan dan membentuk lapisan pelindung (bekuan) untuk mengelakkan kemasukan patogen dan jangkitan. Ia adalah barisan pertahanan pertama badan untuk memulakan penyembuhan tisu lembut.
• Penggunaan Plaster of Paris (Kalsium Sulfat): Ia adalah aplikasi perubatan luaran. Kalsium sulfat digunakan untuk menyokong tulang yang patah. Fungsinya adalah untuk melumpuhkan (immobilize) kawasan yang cedera, memastikan tulang berada pada kedudukan yang betul untuk proses penyembuhan, dan melindunginya daripada kecederaan lanjut. Kesimpulannya, pembekuan darah adalah tindak balas segera badan untuk melindungi daripada jangkitan pada luka luaran, manakala Plaster of Paris adalah sokongan struktur luaran untuk penyembuhan kecederaan dalaman (tulang patah).
——————————————————————————–
Soalan 2: Seorang pelajar ingin menyediakan garam zink sulfat (ZnSO4) yang merupakan garam terlarut. Pelajar tersebut mempunyai serbuk zink karbonat (ZnCO3) dan serbuk zink (Zn). Terangkan dua kaedah berbeza yang boleh digunakan oleh pelajar itu dengan menggunakan asid yang sesuai. Wajarkan kaedah mana yang lebih selamat untuk dijalankan di dalam makmal sekolah.
Jawapan: Dua kaedah yang boleh digunakan ialah:
1. Tindak balas Asid dengan Karbonat Logam: Pelajar boleh menambahkan serbuk zink karbonat (ZnCO3) berlebihan ke dalam asid sulfurik (H2SO4) cair yang dipanaskan. Gas karbon dioksida akan terbebas. Persamaan: ZnCO3 + H2SO4 → ZnSO4 + H2O + CO2.
2. Tindak balas Asid dengan Logam: Pelajar boleh menambahkan serbuk zink (Zn) berlebihan ke dalam asid sulfurik (H2SO4) cair yang dipanaskan. Gas hidrogen akan terbebas. Persamaan: Zn + H2SO4 → ZnSO4 + H2.
Justifikasi Kaedah Lebih Selamat: Kaedah yang lebih selamat ialah tindak balas antara asid dengan zink karbonat. Ini kerana gas yang terhasil, iaitu karbon dioksida (CO2), adalah gas yang tidak mudah terbakar dan tidak meletup. Sebaliknya, kaedah tindak balas antara asid dengan logam zink menghasilkan gas hidrogen (H2). Gas hidrogen adalah sangat mudah terbakar dan boleh menghasilkan bunyi ‘pop’ yang kuat apabila diuji dengan kayu uji bernyala, menandakan ia boleh meletup dalam keadaan tertentu. Oleh itu, penghasilan gas karbon dioksida adalah jauh lebih selamat dalam persekitaran makmal sekolah.
——————————————————————————–
Soalan 3: Rajah 3 menunjukkan Murid K bertindak balas dengan pantas untuk membalas pukulan bulu tangkis. Rajah 2 pula menunjukkan pemindahan impuls saraf. Terangkan bagaimana penggunaan ubat tahan sakit secara berlebihan boleh menjejaskan prestasi Murid K dalam permainan badminton.
Jawapan: Prestasi Murid K bergantung pada penghantaran impuls saraf yang pantas dan cekap untuk membolehkan masa tindak balas yang cepat dan koordinasi otot yang tepat.
• Kesan Ubat Tahan Sakit: Penggunaan ubat tahan sakit secara berlebihan boleh menyekat atau melambatkan pemindahan impuls saraf di sinaps (ruang antara neuron X dan Y dalam Rajah 2). Ia mengganggu pembebasan atau penerimaan neurotransmitter.
• Kesan kepada Prestasi: Apabila pemindahan impuls terganggu, isyarat dari mata Murid K (melihat bulu tangkis) ke otak, dan dari otak ke otot (seperti otot M dan N di lengan) akan menjadi perlahan. Ini akan menyebabkan:
◦ Masa Tindak Balas Lambat: Murid K akan lewat bertindak balas terhadap pukulan lawan.
◦ Koordinasi Otot Terjejas: Pergerakan otot antagonis (M dan N) untuk membengkok dan meluruskan lengan mungkin tidak selancar atau sekuat biasa, menjejaskan kualiti pukulan.
◦ Peningkatan Risiko Kecederaan: Oleh kerana isyarat sakit juga disekat, Murid K mungkin tidak menyedari jika badannya mengalami ketegangan atau kecederaan, lalu terus bermain dan memburukkan lagi keadaan.
——————————————————————————–
Soalan 4: Suatu garam tak diketahui, P, yang berbentuk pepejal dipanaskan dengan kuat. Pemanasan ini membebaskan gas Q yang berwarna perang dan bersifat asid, serta gas R yang menyalakan kayu uji berbara. Baki pemanasan yang tinggal berwarna hitam. Kenal pasti garam P, gas Q, gas R, dan baki pemanasan. Tuliskan persamaan kimia yang seimbang bagi penguraian terma garam P.
Jawapan: Berdasarkan pemerhatian:
• Gas Q berwarna perang dan bersifat asid: Ini adalah ciri-ciri gas nitrogen dioksida (NO2).
• Gas R menyalakan kayu uji berbara: Ini adalah ujian pengesahan untuk gas oksigen (O2).
• Baki pemanasan berwarna hitam: Berdasarkan Jadual 2.7, baki berwarna hitam ialah kuprum(II) oksida (CuO). Ini menunjukkan kehadiran kation kuprum(II) (Cu2+) dalam garam P.
• Inferens: Pemanasan garam nitrat (kecuali NaNO3 dan KNO3) menghasilkan oksida logam, gas nitrogen dioksida, dan gas oksigen. Memandangkan kationnya ialah Cu2+ dan pemanasan menghasilkan NO2 dan O2, maka garam P ialah Kuprum(II) nitrat (Cu(NO3)2).
Persamaan Kimia Seimbang: 2Cu(NO3)2(p) → 2CuO(p) + 4NO2(g) + O2(g)
——————————————————————————–
Soalan 5: Rujuk graf dalam Rajah 4 yang menunjukkan jisim tulang melawan umur bagi wanita penghidap osteoporosis. Terangkan perubahan fisiologi yang berlaku di fasa Y dan cadangkan satu jenis garam daripada teks yang boleh membantu mengurangkan risiko osteoporosis beserta justifikasi.
Jawapan:
• Perubahan Fisiologi di Fasa Y: Fasa Y, yang bermula sekitar umur 40-50 tahun, menunjukkan penurunan jisim tulang yang mendadak. Ini menunjukkan kadar kehilangan jisim tulang melebihi kadar pembinaannya. Bagi wanita, fasa ini selalunya bertepatan dengan menopaus, di mana penurunan hormon estrogen menyebabkan kehilangan ketumpatan tulang yang dipercepat, membawa kepada keadaan osteoporosis.
• Cadangan Garam dan Justifikasi: Garam yang boleh membantu ialah kalsium karbonat (CaCO3).
◦ Justifikasi: Teks menyebut kalsium karbonat digunakan dalam ubat antasid dan kalsium sulfat dalam Plaster of Paris. Tulang sebahagian besarnya terdiri daripada sebatian kalsium. Pengambilan suplemen yang mengandungi ion kalsium (Ca2+), seperti kalsium karbonat, dapat membekalkan bahan mentah yang diperlukan oleh badan untuk membina dan mengekalkan ketumpatan tulang. Ini boleh membantu melambatkan atau mengurangkan kehilangan jisim tulang yang drastik seperti yang dilihat dalam fasa Y.
