Nota Sains Tambahan Tingkatan 5 Bab 4: Tenaga Dan Perubahan Kimia
RINGKASAN
Ringkasan Bab (Nota Sains Tambahan Tingkatan 5 Bab 4: Tenaga Dan Perubahan Kimia)
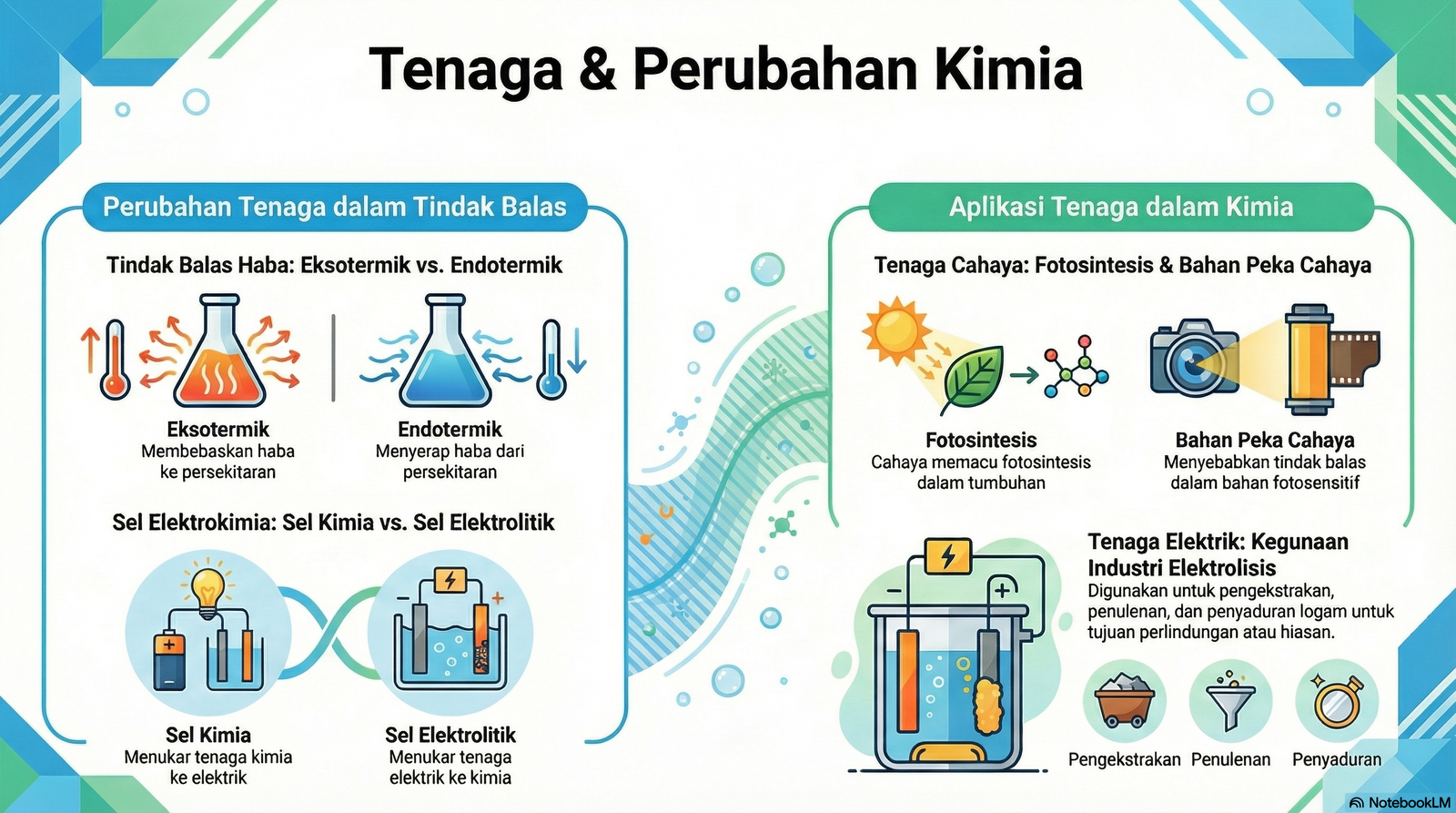
Bab ini meneroka bagaimana pelbagai bentuk tenaga—cahaya, haba, dan elektrik—mempengaruhi dan terhasil daripada tindak balas kimia.
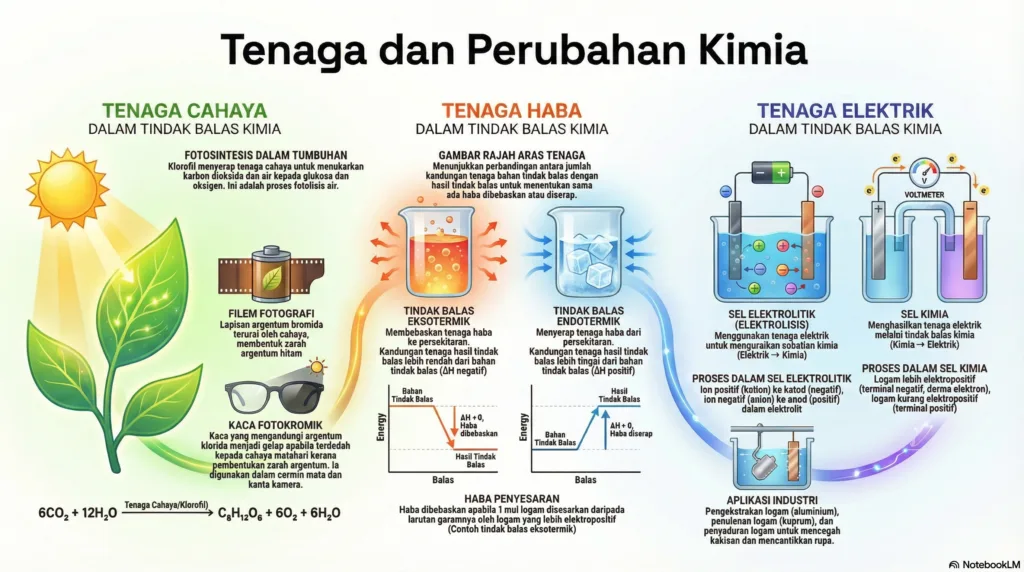
Tenaga Cahaya memainkan peranan penting dalam beberapa proses. Fotosintesis adalah contoh utama di mana tumbuhan hijau menukar tenaga cahaya kepada tenaga kimia untuk menghasilkan glukosa dan oksigen. Tindak balas ini melibatkan fotolisis air, iaitu pemecahan molekul air oleh cahaya. Selain itu, bahan fotosensitif seperti argentum bromida pada filem fotografi dan bahan kimia tertentu terurai apabila terdedah kepada cahaya, menyebabkan ia perlu disimpan dalam botol gelap. Kaca fotokromik, yang menjadi gelap di bawah cahaya terang, berfungsi berdasarkan prinsip yang sama.
Tenaga Haba terlibat dalam semua tindak balas kimia, yang dikelaskan kepada dua jenis. Tindak balas eksotermik adalah tindak balas yang membebaskan haba ke persekitaran, menyebabkan suhu meningkat. Dalam tindak balas ini, kandungan tenaga hasil tindak balas adalah lebih rendah daripada bahan tindak balas (nilai ∆H adalah negatif). Sebaliknya, tindak balas endotermik menyerap haba dari persekitaran, menyebabkan suhu menurun, dan mempunyai kandungan tenaga hasil tindak balas yang lebih tinggi (nilai ∆H adalah positif). Konsep haba penyesaran juga dibincangkan, iaitu haba yang dibebaskan apabila satu mol logam disesarkan daripada larutan garamnya oleh logam yang lebih elektropositif.
Tenaga Elektrik mempunyai hubungan dua hala dengan tindak balas kimia. Dalam sel elektrolitik, tenaga elektrik digunakan untuk menjalankan tindak balas kimia yang tidak spontan melalui proses elektrolisis, iaitu penguraian sebatian dalam keadaan lebur atau akueus. Proses ini mempunyai aplikasi industri yang meluas, termasuk pengekstrakan logam reaktif (seperti aluminium), penulenan logam (seperti kuprum), dan penyaduran logam untuk perlindungan dan estetik. Sebaliknya, sel kimia menukarkan tenaga kimia kepada tenaga elektrik melalui tindak balas kimia spontan, di mana logam yang lebih elektropositif bertindak sebagai terminal negatif dan mendermakan elektron.
Secara keseluruhannya, bab ini memberikan pemahaman asas tentang termodinamik dan elektrokimia, menunjukkan bagaimana tenaga dan jirim saling berinteraksi dalam dunia kimia.
GLOSARI
| Istilah | Definisi |
| Eksotermik | Tindak balas yang membebaskan tenaga haba ke persekitaran. |
| Elektrolisis | Proses penguraian satu sebatian kimia (elektrolit) dalam keadaan lebur atau akueus apabila arus elektrik mengalir melaluinya. |
| Endotermik | Tindak balas yang menyerap tenaga haba dari persekitaran. |
| Fotokromik | Merujuk kepada kaca yang mengandungi argentum klorida atau argentum bromida, yang membolehkannya menjadi gelap apabila terdedah kepada cahaya. |
| Fotolisis Air | Proses pemecahan molekul air kepada ion hidrogen dan oksigen dengan menggunakan tenaga cahaya, lazimnya berlaku semasa fotosintesis. |
| Fotosensitif | Sifat bahan kimia yang peka atau sensitif terhadap cahaya, menyebabkan ia mudah terurai apabila terdedah kepada cahaya. |
| Haba Penyesaran | Haba yang dibebaskan apabila 1 mol logam disesarkan daripada larutan garamnya oleh logam yang lebih elektropositif. |
| Pengekstrakan | Proses untuk mendapatkan logam daripada bijihnya (sebatian semula jadi) melalui kaedah seperti elektrolisis. |
| Penulenan | Proses mengasingkan bendasing daripada logam tidak tulen untuk menghasilkan logam tulen, selalunya melalui elektrolisis. |
| Penyaduran | Proses menyalut permukaan suatu objek logam dengan lapisan nipis logam lain menggunakan elektrolisis untuk tujuan perlindungan atau estetik. |
| Sel Elektrolitik | Susunan radas yang menggunakan tenaga elektrik untuk menghasilkan tindak balas kimia, terdiri daripada elektrod (anod dan katod), elektrolit, dan sumber kuasa (bateri). |
| Sel Kimia | Sel yang menghasilkan tenaga elektrik daripada tindak balas kimia yang berlaku di dalamnya. |
CONTOH SOALAN KBAT
Soalan dan Jawapan KBAT
Berikut adalah lima soalan yang memerlukan pemikiran kritis dan aplikasi konsep yang telah dipelajari.
Soalan 1: Bahan kimia seperti argentum bromida perlu disimpan di dalam botol berwarna gelap, manakala bahan kimia lain seperti larutan natrium klorida boleh disimpan di dalam botol jernih. Jelaskan mengapa amalan penyimpanan yang berbeza ini diperlukan berdasarkan sifat kimia bahan tersebut.
Jawapan: Amalan penyimpanan ini didasarkan pada sifat kepekaan bahan kimia terhadap cahaya, yang dikenali sebagai sifat fotosensitif.
• Argentum bromida: Bahan ini adalah sebatian fotosensitif. Apabila terdedah kepada cahaya, ia akan terurai kepada zarah argentum yang berwarna hitam dan gas bromin (Argentum bromida → Argentum + Bromin). Untuk mengelakkan penguraian ini dan mengekalkan ketulenan bahan kimia, ia mesti disimpan di dalam botol berwarna gelap atau legap yang menghalang kemasukan cahaya.
• Natrium klorida: Bahan ini tidak bersifat fotosensitif. Ia tidak akan bertindak balas atau terurai apabila terdedah kepada cahaya. Oleh itu, tiada keperluan untuk melindunginya daripada cahaya, dan ia boleh disimpan dengan selamat di dalam botol jernih.
Soalan 2: Bandingkan dan bezakan antara sel kimia ringkas (menggunakan elektrod magnesium dan kuprum dalam larutan kuprum(II) sulfat) dengan sel elektrolitik untuk penulenan kuprum dari segi perubahan tenaga, terminal elektrod, dan arah aliran elektron.
Jawapan: Perbandingan antara sel kimia ringkas dan sel elektrolitik adalah seperti berikut:
| Ciri | Sel Kimia Ringkas (Mg & Cu) | Sel Elektrolitik (Penulenan Kuprum) |
| Perubahan Tenaga | Tenaga kimia ditukarkan kepada tenaga elektrik. | Tenaga elektrik digunakan untuk menghasilkan tindak balas kimia. |
| Terminal Negatif | Logam yang lebih elektropositif (Magnesium). | Disambungkan kepada terminal negatif bateri (Katod: Kuprum tulen). |
| Terminal Positif | Logam yang kurang elektropositif (Kuprum). | Disambungkan kepada terminal positif bateri (Anod: Kuprum tidak tulen). |
| Arah Aliran Elektron | Elektron mengalir dari terminal negatif (Magnesium) melalui litar luar ke terminal positif (Kuprum). | Elektron mengalir dari bateri ke katod dan dari anod kembali ke bateri. |
| Proses di Terminal Negatif | Magnesium mengoksida dan mendermakan elektron (Mg → Mg²⁺ + 2e⁻). Pita magnesium menjadi nipis. | Ion kuprum(II) menerima elektron dan terenap sebagai kuprum tulen (Cu²⁺ + 2e⁻ → Cu). Katod menjadi tebal. |
| Proses di Terminal Positif | Ion kuprum(II) dari larutan menerima elektron dan terenap (Cu²⁺ + 2e⁻ → Cu). Jalur kuprum menjadi tebal. | Kuprum tidak tulen mengoksida dan melarut sebagai ion kuprum(II) (Cu → Cu²⁺ + 2e⁻). Anod menjadi nipis. |
Soalan 3: Seorang pengusaha ingin menyadur sudu besi dengan logam kromium untuk melindunginya daripada berkarat dan menjadikannya kelihatan lebih menarik. Berdasarkan prinsip penyaduran logam melalui elektrolisis, reka bentuk satu susunan radas untuk proses ini. Huraikan peranan bagi setiap komponen utama: anod, katod, dan elektrolit.
Jawapan: Reka bentuk susunan radas untuk penyaduran sudu besi dengan kromium adalah seperti berikut:
1. Katod: Sudu besi yang hendak disadur dijadikan katod. Ia disambungkan ke terminal negatif sumber kuasa elektrik (bateri). Sebagai katod, ia akan menarik ion positif dari elektrolit.
2. Anod: Logam penyadur, iaitu kepingan logam kromium tulen, dijadikan anod. Ia disambungkan ke terminal positif sumber kuasa elektrik. Anod akan melarut untuk membekalkan ion logam penyadur ke dalam elektrolit.
3. Elektrolit: Larutan yang digunakan mestilah mengandungi ion logam penyadur, iaitu ion kromium. Contohnya, larutan kromium(III) sulfat. Ion kromium (Cr³⁺) dari elektrolit akan bergerak ke katod (sudu besi), menerima elektron, dan terenap sebagai lapisan nipis logam kromium di permukaan sudu.
Soalan 4: Proses fotosintesis menukarkan tenaga cahaya kepada tenaga kimia. Tindak balas pembakaran magnesium pula adalah satu tindak balas eksotermik. Terangkan perbezaan asas antara kedua-dua proses ini menggunakan konsep perubahan haba (∆H) dan aras tenaga.
Jawapan:
• Fotosintesis: Proses ini menyerap tenaga (dalam bentuk cahaya) untuk menghasilkan molekul bertenaga tinggi (glukosa) daripada molekul bertenaga rendah (karbon dioksida dan air). Ia boleh dianggap sebagai proses endotermik (atau lebih tepat, endergonik) di mana tenaga disimpan dalam ikatan kimia glukosa. Aras tenaga hasil tindak balas (glukosa dan oksigen) adalah lebih tinggi daripada aras tenaga bahan tindak balas (karbon dioksida dan air). Perubahan tenaga ialah tenaga cahaya → tenaga kimia.
• Pembakaran Magnesium (2Mg + O₂ → 2MgO): Ini adalah tindak balas eksotermik, di mana tenaga haba dibebaskan ke persekitaran. Jumlah kandungan tenaga hasil tindak balas (magnesium oksida) adalah lebih rendah daripada jumlah kandungan tenaga bahan tindak balas (magnesium dan oksigen). Oleh itu, nilai perubahan haba (∆H) adalah negatif (contoh: ∆H = –1204 kJ mol⁻¹). Tenaga berlebihan dibebaskan sebagai haba dan cahaya.
Soalan 5: Teks menyatakan bahawa proses kitar semula aluminium hanya menggunakan 9% daripada tenaga yang diperlukan untuk elektrolisis bauksit. Berdasarkan pemahaman tentang proses pengekstrakan logam melalui elektrolisis, jelaskan mengapa pengekstrakan aluminium daripada bijihnya (aluminium oksida) merupakan satu proses yang sangat intensif tenaga.
Jawapan: Pengekstrakan aluminium daripada bijihnya (bauksit, Al₂O₃) sangat intensif tenaga kerana beberapa faktor utama yang berkaitan dengan proses elektrolisis:
1. Takat Lebur Tinggi: Aluminium oksida mempunyai takat lebur yang sangat tinggi. Sejumlah besar tenaga haba diperlukan untuk memanaskan dan meleburkannya sebelum proses elektrolisis boleh dimulakan. Walaupun kriolit (Na₃AlF₆) ditambah untuk merendahkan takat lebur, suhu operasi masih tinggi dan memerlukan input tenaga yang besar untuk mengekalkannya dalam keadaan lebur.
2. Tenaga Elektrik yang Besar: Proses elektrolisis itu sendiri memerlukan sejumlah besar tenaga elektrik. Tenaga ini digunakan untuk menguraikan sebatian aluminium oksida yang stabil kepada unsur aluminium dan oksigen. Proses ini melibatkan pemecahan ikatan kimia yang kuat, yang memerlukan input tenaga elektrik yang berterusan dan tinggi. Proses kitar semula hanya perlu meleburkan semula logam aluminium, yang memerlukan tenaga jauh lebih rendah berbanding dengan memecahkan ikatan kimia dalam bijih asalnya.
